题目内容
(2006?建邺区一模)以下是常见的实验装置图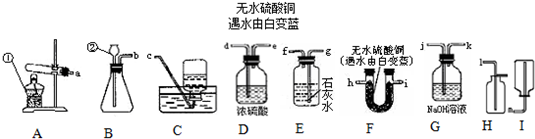
(1)图中有标号的仪器名称是:①
(2)制取并收集干燥的CO2气体,选用的装置组合是
(3)某化学研究性小组的同学选用上述装置对常见化肥进行了探究:
碳酸氢铵(NH4HCO3)是一种常见的
(4)如用H2O2和MnO2制氧气,应选用
对此实验,让我们继续思考并研究几个问题:
问题①:催化剂MnO2的用量对反应速率有没无影响,我的实验方案是:每次均用30mL10%的H2O2溶液,采用不同量MnO2粉末做催化剂,测定各次收集到500mL氧气时所用的时间,结果如下:(其他实验条件均相同)
请你分析表中数据回答:MnO2的用量对反应速率有无影响,如果有,怎样影响?
答:
问题②:H2O2溶液的溶质质量分数对反应速率有没有影响,你的实验方案是:
答:
问题③:还有哪些因素可能影响该反应的速率呢?
请说出你的一个猜想:
问题④:已知氧气在该实验条件下的密度为1.28g/L,若要制取250mL氧气,计算理论上至少需要消耗30%的H2O2溶液多少克?(相对原子质量:H-1O-16)

(1)图中有标号的仪器名称是:①
酒精灯
酒精灯
②长颈漏斗
长颈漏斗
(2)制取并收集干燥的CO2气体,选用的装置组合是
BDH或BFH
BDH或BFH
(填装置字母代号,下同),检验是否收集满的方法是将燃着的木条放在瓶口,观察是否熄灭
将燃着的木条放在瓶口,观察是否熄灭
.制取该气体的化学方程式是CaCO3+2HCl═CaCl2+H2O+CO2↑
CaCO3+2HCl═CaCl2+H2O+CO2↑
;小明建议将稀盐酸换成浓盐酸,你认为此方法可行吗?不可行
不可行
(填“可行”或“不可行”),理由是浓盐酸具有挥发性,使CO2中混入HCl气体
浓盐酸具有挥发性,使CO2中混入HCl气体
.(3)某化学研究性小组的同学选用上述装置对常见化肥进行了探究:
碳酸氢铵(NH4HCO3)是一种常见的
氮
氮
肥,受热易分解生成三种化合物,其中一种是氨气(NH3),另两种可能是CO2
CO2
、H2O
H2O
;为了证明此猜想,选择上述部分装置,各接口的连接顺序是a接h
h
接i
i
接g
g
.(4)如用H2O2和MnO2制氧气,应选用
B
B
作为发生装置,其化学反应方程式为2H2O2
2H2O+O2↑
| ||
2H2O2
2H2O+O2↑
.
| ||
对此实验,让我们继续思考并研究几个问题:
问题①:催化剂MnO2的用量对反应速率有没无影响,我的实验方案是:每次均用30mL10%的H2O2溶液,采用不同量MnO2粉末做催化剂,测定各次收集到500mL氧气时所用的时间,结果如下:(其他实验条件均相同)
| 实验次序 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| MnO2粉末用量(g) | 0.1 | 0.2 | 0.3 | 0.4 | 0.5 | 0.6 | 0.7 | 0.8 |
| 所用时间(t) | 17 | 8 | 7 | 5 | 4 | 3 | 2 | 2 |
答:
有影响,在一定范围内,MnO2的用量越大,反应越快
有影响,在一定范围内,MnO2的用量越大,反应越快
.问题②:H2O2溶液的溶质质量分数对反应速率有没有影响,你的实验方案是:
答:
每次用等量的MnO2,采用足量不同溶质质量分数的H2O2溶液进行实验,观察收集等量气体时所消耗的时间
每次用等量的MnO2,采用足量不同溶质质量分数的H2O2溶液进行实验,观察收集等量气体时所消耗的时间
.问题③:还有哪些因素可能影响该反应的速率呢?
请说出你的一个猜想:
MnO2颗粒大小有关
MnO2颗粒大小有关
.问题④:已知氧气在该实验条件下的密度为1.28g/L,若要制取250mL氧气,计算理论上至少需要消耗30%的H2O2溶液多少克?(相对原子质量:H-1O-16)
分析:制取装置包括加热和不需加热两种,如果用双氧水制氧气就不需要加热,如果用高锰酸钾或氯酸钾制氧气就需要加热.氧气的密度比空气的密度大,不易溶于水,因此能用向上排空气法和排水法收集.实验室制取CO2,是在常温下,用碳酸钙和盐酸互相交换成分生成氯化钙和水和二氧化碳,因此不需要加热.二氧化碳能溶于水,密度比空气的密度大,因此只能用向上排空气法收集;二氧化碳可以用浓硫酸或无水硫酸铜干燥;二氧化碳的验满方法是:将一根燃着的木条平放在集气瓶口,木条熄灭,证明满了;不能稀盐酸换成浓盐酸,因为浓盐酸具有挥发性,使CO2中混入HCl气体.碳酸氢铵(NH4HCO3)是一种常见的氮肥,受热易分解生成氨气、水和二氧化碳,检验时,为了避免干扰,应该先检验水再检验二氧化碳,水用无水硫酸铜检验,二氧化碳用澄清的石灰水检验;用控制变量法研究反应因素对化学反应因素的影响时,注意只能控制一个变量.
解答:解:(1)酒精灯是常用的加热仪器,长颈漏斗方便加液体药品,故答案为:酒精灯;长颈漏斗
(2)实验室制取CO2,是在常温下,用碳酸钙和盐酸互相交换成分生成氯化钙和水和二氧化碳,因此不需要加热.二氧化碳能溶于水,密度比空气的密度大,因此只能用向上排空气法收集;二氧化碳可以用浓硫酸或无水硫酸铜干燥;二氧化碳的验满方法是:将一根燃着的木条平放在集气瓶口,木条熄灭,证明满了;不能稀盐酸换成浓盐酸,因为浓盐酸具有挥发性,使CO2中混入HCl气体;故答案为:BDH或BFH;将燃着的木条放在瓶口,观察是否熄灭; CaCO3+2HCl═CaCl2+H2O+CO2↑;不可行; 浓盐酸具有挥发性,使CO2中混入HCl气体
(3)碳酸氢铵(NH4HCO3)是一种常见的氮肥,受热易分解生成氨气、水和二氧化碳,检验时,为了避免干扰,应该先检验水再检验二氧化碳,水用无水硫酸铜检验,二氧化碳用澄清的石灰水检验;故答案为:氮; CO2;H2O; h i g
(4)如果用双氧水制氧气就不需要加热,过氧化氢在二氧化锰做催化剂的条件下生成水和氧气;在一定范围内,MnO2的用量越大,反应越快;每次用等量的MnO2,采用足量不同溶质质量分数的H2O2溶液进行实验,观察收集等量气体时所消耗的时间;MnO2颗粒大小、环境温度、气压、是否振荡等,都会影响反应的速度;故答案为:B;2H2O2
2H2O+O2↑;问题①:有影响.在一定范围内,MnO2的用量越大,反应越快;问题②:每次用等量的MnO2,采用足量不同溶质质量分数的H2O2溶液进行实验,观察收集等量气体时所消耗的时间;问题③:MnO2颗粒大小、环境温度、气压、是否振荡等,合理答案均可得分
问题④:氧气质量=1.28g/L×0.25L=0.32g
设理论上至少需要消耗30%的H2O2溶液的质量为x
2H2O2
2H2O+O2↑;
68 32
30%x 0.32g
=
x≈2.3g
故答案为:2.3g
(2)实验室制取CO2,是在常温下,用碳酸钙和盐酸互相交换成分生成氯化钙和水和二氧化碳,因此不需要加热.二氧化碳能溶于水,密度比空气的密度大,因此只能用向上排空气法收集;二氧化碳可以用浓硫酸或无水硫酸铜干燥;二氧化碳的验满方法是:将一根燃着的木条平放在集气瓶口,木条熄灭,证明满了;不能稀盐酸换成浓盐酸,因为浓盐酸具有挥发性,使CO2中混入HCl气体;故答案为:BDH或BFH;将燃着的木条放在瓶口,观察是否熄灭; CaCO3+2HCl═CaCl2+H2O+CO2↑;不可行; 浓盐酸具有挥发性,使CO2中混入HCl气体
(3)碳酸氢铵(NH4HCO3)是一种常见的氮肥,受热易分解生成氨气、水和二氧化碳,检验时,为了避免干扰,应该先检验水再检验二氧化碳,水用无水硫酸铜检验,二氧化碳用澄清的石灰水检验;故答案为:氮; CO2;H2O; h i g
(4)如果用双氧水制氧气就不需要加热,过氧化氢在二氧化锰做催化剂的条件下生成水和氧气;在一定范围内,MnO2的用量越大,反应越快;每次用等量的MnO2,采用足量不同溶质质量分数的H2O2溶液进行实验,观察收集等量气体时所消耗的时间;MnO2颗粒大小、环境温度、气压、是否振荡等,都会影响反应的速度;故答案为:B;2H2O2
| ||
问题④:氧气质量=1.28g/L×0.25L=0.32g
设理论上至少需要消耗30%的H2O2溶液的质量为x
2H2O2
| ||
68 32
30%x 0.32g
| 68 |
| 32 |
| 30%x |
| 0.32g |
故答案为:2.3g
点评:本考点主要考查了仪器的名称、气体的检验和干燥、气体的制取装置和收集装置的选择,同时也考查了化学方程式的书写、有关的计算和反应因素的影响等,综合性比较强.气体的制取装置的选择与反应物的状态和反应的条件有关;气体的收集装置的选择与气体的密度和溶解性有关,有关的计算要准确.本考点是中考的重要考点之一,主要出现在实验题中.

练习册系列答案
 备战中考寒假系列答案
备战中考寒假系列答案
相关题目
 ”表示氢原子,“
”表示氢原子,“ ”表示氧原子)
”表示氧原子)



 (2006?建邺区一模)已知A、B、C三种固体物质的溶解度曲线如图所示,则下列叙述中正确的是( )
(2006?建邺区一模)已知A、B、C三种固体物质的溶解度曲线如图所示,则下列叙述中正确的是( )