题目内容
硫化氢(H2S)是一种具有臭鸡蛋气味的有毒气体,它的密度比空气大,可溶于水形成氢硫酸,氢硫酸具有酸的通性.实验室常用固体硫化亚铁(FeS)和稀硫酸在常温下制得H2S,同时生成FeSO4.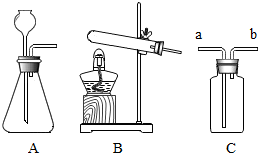
(1)收集H2S气体时,应从C装置中的 导管进入,对产生尾气的处理方法是: .
(2)实验室若制取6.8克的硫化氢气体,理论上需要多少克20%的硫酸溶液?

(1)收集H2S气体时,应从C装置中的
(2)实验室若制取6.8克的硫化氢气体,理论上需要多少克20%的硫酸溶液?
考点:常用气体的收集方法,酸的化学性质,根据化学反应方程式的计算
专题:有关化学方程式的计算,常见气体的实验室制法、检验、干燥与净化
分析:(1)根据气体的物理性质可以选择收集方法;
(2)根据反应的化学方程式、硫化氢的质量可以计算20%的硫酸溶液的质量.
(2)根据反应的化学方程式、硫化氢的质量可以计算20%的硫酸溶液的质量.
解答:解:(1)硫化氢能够溶于水,不能用排水法收集,硫化氢的密度比空气大,可以用向上排空气法收集,用C装置收集硫化氢时,应从C装置中的a导管进入;
因为硫化氢溶于水形成氢硫酸,氢硫酸具有酸的通性,可以用碱性溶液吸收硫化氢,例如可以用氢氧化钠溶液、氢氧化钾溶液等吸收.
故答案为:a;用氢氧化钠溶液吸收.
(2)解:设需要20%硫酸溶液的质量为X,
H2S04+FeS=H2S↑++FeS04
98 34
X×20% 6.8g
=
X=98g;
答:需要20%硫酸溶液的质量为98g.
因为硫化氢溶于水形成氢硫酸,氢硫酸具有酸的通性,可以用碱性溶液吸收硫化氢,例如可以用氢氧化钠溶液、氢氧化钾溶液等吸收.
故答案为:a;用氢氧化钠溶液吸收.
(2)解:设需要20%硫酸溶液的质量为X,
H2S04+FeS=H2S↑++FeS04
98 34
X×20% 6.8g
| 98 |
| 34 |
| X×20% |
| 6.8g |
X=98g;
答:需要20%硫酸溶液的质量为98g.
点评:本题考查装置的选择、根据化学方程式计算,比较简单,计算时要注意规范性和准确性.

练习册系列答案
相关题目
下列事实不能用分子、原子之间有间隔的观点解释的是( )
| A、100mL水和100mL酒精混合后,总体积小于200mL |
| B、将一滴品红溶液滴入水中,一段时间后,水全部变红 |
| C、100g细粒状大理石比100g整块大理石体积大 |
| D、建筑工人在修路时,每隔一段路面都要留一段缝隙 |
 ”和“
”和“ ”分别代表两种不同的单质分子A2和B2,它们在一定条件下能发生化学反应,其反应的微观示意图如下:
”分别代表两种不同的单质分子A2和B2,它们在一定条件下能发生化学反应,其反应的微观示意图如下: