题目内容
有一种石灰石样品,(杂质是一种不溶于水,不与盐酸反应,耐高温的固体物质),某同学想测定该样品的纯度,他取用2g这种石灰石样品,把20g稀盐酸分四次加入,充分反应后剩余固体的质量见下表所示:
(1)求石灰石样品的纯度
(2)求盐酸溶液的溶质质量分数.
| 稀盐酸的质量 | 剩余固体的质量 |
| 第1次加入5g | 1.3g |
| 第2次加入5g | 0.6g |
| 第3次加入5g | 0.2g |
| 第4次加入5g | 0.2g |
(2)求盐酸溶液的溶质质量分数.
考点:根据化学反应方程式的计算,有关溶质质量分数的简单计算
专题:综合计算(图像型、表格型、情景型计算题)
分析:(1)由于样品中除碳酸钙外,其余的成分既不与盐酸反应,也不溶解于水,因此由表中每次加入5g稀盐酸固体减少的质量关系可判断:每加入5g稀盐酸固体应减少0.7g;据此规律,由第三次加入盐酸后固体质量的减少值小于0.7g可判断此次反应后碳酸钙已完全反应,则剩余0.2g为杂志的质量,利用样品杂质的质量,由此求出石灰石样品中碳酸钙的质量分数;
(2)每5g盐酸会消耗0.7g的碳酸钙,利用这一关系可求稀盐酸的质量分数.
(2)每5g盐酸会消耗0.7g的碳酸钙,利用这一关系可求稀盐酸的质量分数.
解答:解:(1)每加入5g稀盐酸固体应减少0.7g;据此规律,由第三次加入盐酸后固体质量的减少值小于0.7g可判断此次反应后碳酸钙已完全反应,则剩余0.2g为杂志的质量,则样品中碳酸钙的质量为:2g-0.2g=1.8g,
石灰石样品的纯度为:
×100%=90%;
(2)设5g盐酸中氯化氢的质量为x
CaCO3+2HCl=CaCl2+H2O+CO2↑
100 73
0.7g x
=
x=51.1%
答:盐酸溶液的溶质质量分数为51.1%.
石灰石样品的纯度为:
| 1.8g |
| 2g |
(2)设5g盐酸中氯化氢的质量为x
CaCO3+2HCl=CaCl2+H2O+CO2↑
100 73
0.7g x
| 100 |
| 73 |
| 0.7g |
| x |
x=51.1%
答:盐酸溶液的溶质质量分数为51.1%.
点评:此题是考查学生对图表的分析能力,并利用分析结果进行计算,关键是把握住完全反应的数据,利用有用的数据进行计算.

练习册系列答案
 通城学典默写能手系列答案
通城学典默写能手系列答案 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案
相关题目
下列关于催化剂的说法正确的是( )
| A、二氧化锰在所有反应中都是催化剂 |
| B、催化剂一定能加快化学反应的速率 |
| C、没有催化剂,过氧化氢溶液就不反应 |
| D、在过氧化氢溶液反应中,二氧化锰的质量没有发生变化 |
小东同学对部分物质的性质和用途归纳如下,其中正确的是( )
A、 稀有气体填充食品袋防腐 |
B、 氧气用于气焊 |
C、 氮气通电制霓虹灯 |
D、 氧气用于光合作用 |
下列符号中,既能表示一种元素,又能表示这种元素的一个原子,还能表示一种物质的是( )
| A、C | B、H |
| C、N2 | D、S |
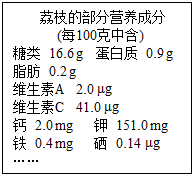 茂名是著名的水果之乡,盛产荔枝,荔枝的部分营养成分如图.请回答:
茂名是著名的水果之乡,盛产荔枝,荔枝的部分营养成分如图.请回答: