题目内容
工业炼铁是把铁矿石和焦炭等原料一起加入高炉,在高温下通入空气进行一系列反应把铁还原出来.计算:
(1)Fe2O3的相对分子质量是:______;
(2)5000t含氧化铁84%的赤铁矿中,其氧化铁的质量是______t;
(3)上述赤铁矿理论上可炼得含铁98%的生铁______t.
解:(1)Fe2O3的相对分子质量是56×2+16×3=160.
(2)5000t含氧化铁84%的赤铁矿中,其氧化铁的质量是5000t×84%=4200t.
(3)设理论上可炼出含铁98%的生铁质量为x.
Fe2O3+3CO 2Fe+3CO2
2Fe+3CO2
160 112
4200t 98%x
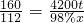 x=3000t
x=3000t
故答案为:(1)160;(2)4200t;(3)3000.
分析:(1)根据相对分子质量为构成分子的各原子的相对原子质量之和,进行分析解答.
(2)根据矿石的质量和氧化铁的质量分数计算矿石中氧化铁的质量即可.
(3)由氧化铁的质量、生铁中铁的质量分数,根据赤铁矿炼铁的化学方程式可以列式计算出炼出生铁的质量.
点评:本题难度不大,主要考查含杂质物质的化学方程式的计算,注意代入方程式计算的必须是纯物质的质量是正确解答此类题的关键.
(2)5000t含氧化铁84%的赤铁矿中,其氧化铁的质量是5000t×84%=4200t.
(3)设理论上可炼出含铁98%的生铁质量为x.
Fe2O3+3CO
 2Fe+3CO2
2Fe+3CO2160 112
4200t 98%x
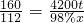 x=3000t
x=3000t故答案为:(1)160;(2)4200t;(3)3000.
分析:(1)根据相对分子质量为构成分子的各原子的相对原子质量之和,进行分析解答.
(2)根据矿石的质量和氧化铁的质量分数计算矿石中氧化铁的质量即可.
(3)由氧化铁的质量、生铁中铁的质量分数,根据赤铁矿炼铁的化学方程式可以列式计算出炼出生铁的质量.
点评:本题难度不大,主要考查含杂质物质的化学方程式的计算,注意代入方程式计算的必须是纯物质的质量是正确解答此类题的关键.

练习册系列答案
相关题目
