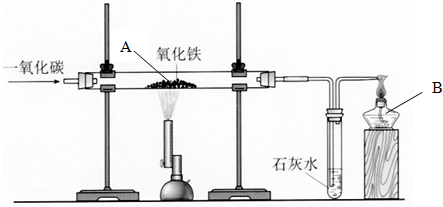
题目内容
工业炼铁是把铁矿石和焦炭等原料一起加入高炉,在高温下通入空气进行一系列反应把铁还原出来.(1)通入空气使固态的焦炭转化为具有还原性的气态物质,转化过程中涉及的反应的化学方程式是
(2)赤铁矿(主要成分为Fe2O3)在高炉里反应生成单质铁的化学方程式是
(3)汁算:
①氧化铁(Fe2O3)的相对分子质量是
②5000t含氧化铁84%的赤铁矿中,氧化铁的质量是
③上述赤铁矿理论上可炼得含铁98%的生铁
分析:(1)焦炭可与氧气反应生成二氧化碳,二氧化碳在高温条件下可与焦炭反应生成一氧化碳;一氧化碳为炼铁的还原剂;
(2)一氧化碳还原剂在高温下可夺取氧化铁中的氧而使氧化铁失氧被还原成铁,同时生成二氧化碳;
(3)根据赤铁矿中氧化铁的含量计算出氧化铁的质量,再根据氧化铁中铁元素的质量分数计算出赤铁矿中含有铁元素的质量;利用所得生铁中含铁元素的质量与铁矿石中铁元素质量相等,计算出生铁的质量.
(2)一氧化碳还原剂在高温下可夺取氧化铁中的氧而使氧化铁失氧被还原成铁,同时生成二氧化碳;
(3)根据赤铁矿中氧化铁的含量计算出氧化铁的质量,再根据氧化铁中铁元素的质量分数计算出赤铁矿中含有铁元素的质量;利用所得生铁中含铁元素的质量与铁矿石中铁元素质量相等,计算出生铁的质量.
解答:解:
(1)焦炭在空气为燃烧生成二氧化碳,生成的二氧化碳在高温条件下与焦炭发生反应,生成具有还原性的气体一氧化碳,C+O2
CO2,CO2+C
2CO;
(2)在高温条件下,一氧化碳还原氧化铁得到单质铁和二氧化碳,Fe2O3+3CO
2Fe+3CO2;
(3)氧化铁(Fe2O3)的相对分子质量=56×2+16×3=160
5000t含氧化铁84%的赤铁矿中,氧化铁的质量=5000t×84%=4200t
5000t赤铁矿中含铁元素的质量=4200t×
×100%=2940t
理论上可炼得含铁98%的生铁的质量=
=3000t
故答案为:
(1)C+O2
CO2,CO2+C
2CO;
(2)3CO+Fe2O3
2Fe+3CO2
(3)①160;②4200;③3000.
(1)焦炭在空气为燃烧生成二氧化碳,生成的二氧化碳在高温条件下与焦炭发生反应,生成具有还原性的气体一氧化碳,C+O2
| ||
| ||
(2)在高温条件下,一氧化碳还原氧化铁得到单质铁和二氧化碳,Fe2O3+3CO
| ||
(3)氧化铁(Fe2O3)的相对分子质量=56×2+16×3=160
5000t含氧化铁84%的赤铁矿中,氧化铁的质量=5000t×84%=4200t
5000t赤铁矿中含铁元素的质量=4200t×
| 56×2 |
| 160 |
理论上可炼得含铁98%的生铁的质量=
| 2940t |
| 98% |
故答案为:
(1)C+O2
| ||
| ||
(2)3CO+Fe2O3
| ||
(3)①160;②4200;③3000.
点评:铁的冶炼是利用还原剂一氧化碳把铁的氧化物中的铁还原成单质铁的过程,过程中铁元素的质量不变.

练习册系列答案
相关题目