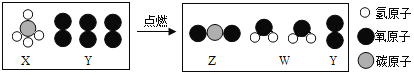
��Ŀ����
����Ŀ����ͼ��ʾ������ʵ�������֤������ܷ�����Ӧ����ͼ�ش��������⣺
��1��ʵ��һ�۲쵽������ɫ�����������ʧ����֤��������ܷ�����Ӧ��д��������ɫ�����Ļ�ѧ����ʽ_____��
��2��ʵ���ͨ����ֻ�Թ��е�����Աȣ������ж�ϡ������Ca��OH��2�ܷ�Ӧ����ʵ�������Ҫ��������ˮ��ϡ������¶ȡ������ͬ�⣬�������_____��ͬ��
��3��ʵ�����У�����X����֤ϡ��������ܷ�����Ӧ����X���������������е�_____������ĸ��ţ���
A ��̪ B CuO C Na2CO3 D Ba��NO3��2
���𰸡�2NaOH+CuSO4��Cu��OH��2��+Na2SO4 �������Ʒ�ĩ������ A��B
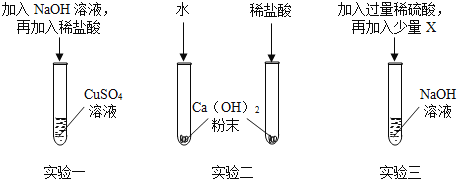
��������
��1����������������ͭ��Ӧ����������ͭ��ɫ��������Ӧ����ʽ��2NaOH+CuSO4��Cu��OH��2��+Na2SO4��
��2���ɿ��Ʊ�������������ʵ���г���ˮ��ϡ��������ͬ�⣬�����������뱣����ͬ��ˮ��ϡ������¶ȡ������ͬ��������� �������Ʒ�ĩ��������ͬ��
��3��A���ڼ��м�������������Һ�����ԣ��ټ����̪����Һ��Ϊ��ɫ��˵�����Ѿ��������ˣ�����֤���������ȷʵ�����˷�Ӧ����A���ϣ�
B�����H2SO4��NaOHû�з�Ӧ����ô����CuO��CuO��H2SO4��Ӧ����CuSO4��CuSO4�������NaOH��Ӧ����Cu��OH��2��ɫ��״���������H2SO4��NaOH�����˷�Ӧ����CuO�������H2SO4��Ӧ����CuSO4��������NaOH�ѷ�Ӧ����������ɫ��״������������B���ϣ�
C�����������ǹ����ģ�����H2SO4��NaOH��û�з�����Ӧ��C���������ݲ�����
D�����ᱵ�����ᡢ�����Ʒ�Ӧ�����ɰ�ɫ������������ᱵ��Һ������֤ϡ������Ӧ����D�����ϡ�

 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�����Ŀ����ѧ��ȤС��̽������������ʱ����һ��ȥ������Ĥ��þ��������һ������ϡ�����У������ݲ�������ַ�Ӧ���ã������Թ����лҰ�ɫ������д���������ݵķ�Ӧ��ѧ����ʽ______��
��������⣩�Ұ�ɫ������ʲô���ʣ�
��������裩��С����Ϊ�Ұ�ɫ����Ϊ̼��þ��MgCO3��������ͬѧ��Ϊ����Ҫʵ����ܷ�С���IJ��룬������_____________________��
��С����Ϊ���ڷ�Ӧ���Ȼ�þ��������ƫ�࣬�Ұ�ɫ����Ϊ�������ܽ���Ȼ�þ���塣
��Сͮ��Ϊ�Ұ�ɫ����Ϊ__________________��
��ʵ��̽��1��
ʵ����� | ���� | ���� |
��ȡ�Թ��е��ϲ���Һ�������������Ȼ�þ���� | �Ȼ�þ����__��ѡ�����ܽ����������ܽ����� | С�������� |
��ȡ������ɫ������������ϡ������ | û������ð�� | Сͮ������� |
��������̽���������ԭ�в������˷�
���������ϣ�
HCl+AgNO3�THNO3+AgCl����AgCl��һ�ְ�ɫ�������Ȼ������������壬��ʹ��ɫʯ����ֽ��졣����
��ʵ��̽��2��
��������ȡ�Ұ�ɫ���������Թ��м��ȣ���պ����������Һ�IJ����������Թ��ڣ��������ϵ���Һ���ְ�ɫ���ǣ�֤��������__���塣��μ�����������_______��ʵ�鲽�衢�����ۣ���
ͬѧ�������ʦ���֪��������þ��ϡ���ᷴӦʱ����Һ�ᾭ�������Ե������Ҽ�������ǿ�Ĺ��̣��Ӷ������˼�ʽ�Ȼ�þ�������������ܣ���ʽ�Ȼ�þ���ڶ�����ɽṹ����ѧͨʽ�ɱ�ʾΪMgx��OH��yClzmH2O������2x��y��z=0��0��m��6����
����˼��չ��
��1����þ��ϡ���ᷴӦ��ʵ��ʱ��Ϊ�˲����Թ��г��ֻҰ�ɫ������þ��������_______��
��2����Ƭ��ͭƬ����ϡ�����в���������Ҳ����ͬ���ݴ��Ʋ�����Ļ�Ա�ͭ_____��