题目内容
有MgO和Fe2O3,组成的混合物lOg,放入足量的稀盐酸中充分反应后,测得共生成水3.6g.则混合物中氧元素的质量分数为 .
【答案】分析:根据化合物中某元素的质量=该化合物的质量×该元素的质量分数,结合质量守恒定律进行分析解答.
解答:解:MgO和Fe2O3与稀盐酸反应生成氯化镁、氯化铁和水,生成的3.6g水中氧元素的质量为:3.6g× 100%=3.2g;由质量守恒定律原混合物中氧元素的质量为3.2g,则则混合物中氧元素的质量分数为
100%=3.2g;由质量守恒定律原混合物中氧元素的质量为3.2g,则则混合物中氧元素的质量分数为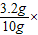 100%=32%.
100%=32%.
故答案为:32%.
点评:本题难度不大,考查同学们结合质量守恒定律、灵活运用化学式的有关计算进行分析问题、解决问题的能力.
解答:解:MgO和Fe2O3与稀盐酸反应生成氯化镁、氯化铁和水,生成的3.6g水中氧元素的质量为:3.6g×
 100%=3.2g;由质量守恒定律原混合物中氧元素的质量为3.2g,则则混合物中氧元素的质量分数为
100%=3.2g;由质量守恒定律原混合物中氧元素的质量为3.2g,则则混合物中氧元素的质量分数为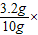 100%=32%.
100%=32%.故答案为:32%.
点评:本题难度不大,考查同学们结合质量守恒定律、灵活运用化学式的有关计算进行分析问题、解决问题的能力.

练习册系列答案
相关题目