题目内容
有MgO和Fe2O3组成的混合物10g,放入足量的稀盐酸中充分反应后测得共生成水3.6g,则混合物中氧元素的质量分数( )A.40%
B.36%
C.32%
D.30%
【答案】分析:因金属氧化物与盐酸反应生成氯化盐和水,由元素守恒可知混合物中氧元素的质量即为水中氧元素的质量,然后来计算来计算混合物中氧元素的质量分数即可.
解答:解:由金属氧化物与盐酸反应生成氯化盐和水,
则水中氧元素的质量即为混合物中氧元素的质量,
水中氧元素的质量为3.6g×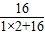 ×100%=3.2g,
×100%=3.2g,
又的混合物的质量为10g,
则混合物中氧元素的质量分数为 ×100%=32%,
×100%=32%,
故选C.
点评:本题考查金属氧化物与酸的反应及利亚元素守恒的计算,学生熟悉利用化学式来计算元素的质量分数即可解答.
解答:解:由金属氧化物与盐酸反应生成氯化盐和水,
则水中氧元素的质量即为混合物中氧元素的质量,
水中氧元素的质量为3.6g×
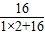 ×100%=3.2g,
×100%=3.2g,又的混合物的质量为10g,
则混合物中氧元素的质量分数为
 ×100%=32%,
×100%=32%,故选C.
点评:本题考查金属氧化物与酸的反应及利亚元素守恒的计算,学生熟悉利用化学式来计算元素的质量分数即可解答.

练习册系列答案
 名牌学校分层周周测系列答案
名牌学校分层周周测系列答案 黄冈海淀全程培优测试卷系列答案
黄冈海淀全程培优测试卷系列答案
相关题目