题目内容
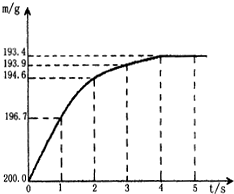 向盛有含杂质的碳酸氢钠固体(NaHCO3)20.0g的烧杯中,加入一定量的稀硫酸溶液恰好反应(杂质不反应).反应过程用精密仪器测得烧杯连同药品的质量(m)与反应时间(t)的关系如图所示.烧杯连同药品的起始质量为202.2g.反应的化学方程式为:
向盛有含杂质的碳酸氢钠固体(NaHCO3)20.0g的烧杯中,加入一定量的稀硫酸溶液恰好反应(杂质不反应).反应过程用精密仪器测得烧杯连同药品的质量(m)与反应时间(t)的关系如图所示.烧杯连同药品的起始质量为202.2g.反应的化学方程式为:2NaHCO3+H2SO4=Na2SO4+2H2O+2CO2↑
回答下列问题:
(1)当碳酸氢钠与硫酸溶液完全反应时,所产生二氧化碳的质量为
(2)计算求出含杂质的碳酸氢钠固体中含碳酸氢钠质量分数.
考点:根据化学反应方程式的计算
专题:综合计算(图像型、表格型、情景型计算题)
分析:(1)根据题意及题给图示,烧杯连同药品的起始质量为200.0g,碳酸氢钠与硫酸溶液恰好完全反应后烧杯连同药品的质量为193.4g,根据该反应的化学方程式及质量守恒定律求得产生二氧化碳的质量;
(2)根据求得的二氧化碳的质量为已知量带入化学方程式求得碳酸氢钠的质量,进而求出碳酸氢钠的质量分数即可.
(2)根据求得的二氧化碳的质量为已知量带入化学方程式求得碳酸氢钠的质量,进而求出碳酸氢钠的质量分数即可.
解答:解:(1)根据题意及题给图示,烧杯连同药品的起始质量为200.0g,碳酸氢钠与硫酸溶液恰好完全反应后烧杯连同药品的质量为193.4g,由质量守恒定律求得生成二氧化碳的质量为:200.0g-193.4g=6.6g;故填:6.6g;
(2)设碳酸氢钠的质量为x
2NaHCO3+H2SO4=Na2SO4+2H2O+2CO2↑
168 88
x 6.6g
=
x=12.6g
含杂质的碳酸氢钠固体中碳酸氢钠的质量分数=
×100%=63%
答:含杂质的碳酸氢钠固体中碳酸氢钠的质量分数为63%.
(2)设碳酸氢钠的质量为x
2NaHCO3+H2SO4=Na2SO4+2H2O+2CO2↑
168 88
x 6.6g
| 168 |
| x |
| 88 |
| 6.6g |
x=12.6g
含杂质的碳酸氢钠固体中碳酸氢钠的质量分数=
| 12.6g |
| 20g |
答:含杂质的碳酸氢钠固体中碳酸氢钠的质量分数为63%.
点评:此题主要考查利用题给信息找到已知量,而后利用化学方程式进行计算,该题能很好的锻炼学生的思维解题能力.

练习册系列答案
相关题目
下列物质属于纯净物的是( )
| A、空气 | B、蔗糖水 | C、果汁 | D、液氧 |

 等质量的两种常见金属A和B,分别与足量稀硫酸反应生成正二价金属硫酸盐和氢气,氢气质量与反应时间的关系如右图所示.由曲线可以初步推断:相同的时间里生成氢气的质量A
等质量的两种常见金属A和B,分别与足量稀硫酸反应生成正二价金属硫酸盐和氢气,氢气质量与反应时间的关系如右图所示.由曲线可以初步推断:相同的时间里生成氢气的质量A