题目内容
 等质量的两种常见金属A和B,分别与足量稀硫酸反应生成正二价金属硫酸盐和氢气,氢气质量与反应时间的关系如右图所示.由曲线可以初步推断:相同的时间里生成氢气的质量A
等质量的两种常见金属A和B,分别与足量稀硫酸反应生成正二价金属硫酸盐和氢气,氢气质量与反应时间的关系如右图所示.由曲线可以初步推断:相同的时间里生成氢气的质量A考点:金属的化学性质
专题:金属与金属材料
分析:根据题意,等质量的两种常见金属A和B,分别与足量稀硫酸反应生成正二价金属硫酸盐和氢气,由氢气质量与反应时间的关系图,可以确定生成氢气的质量;进而结合金属的活动性越强,与酸反应的速率越快,进行分析解答.
解答:解:等质量的两种常见金属A和B,分别与足量稀硫酸反应生成正二价金属硫酸盐和氢气,由氢气质量与反应时间的关系图,向横坐标做垂线,找出同一时间,与斜线的交点越高,则产生的氢气越多,A高于B,则相同的时间里生成氢气的质量A>B.
由氢气质量与反应时间的关系图,等质量的两种常见金属A和B,至完全反应,A用的时间少,B用的时间多,由金属的活动性越强,与酸反应的速率越快,则金属活动性顺序A>B.
由等质量的两种常见金属A和B,分别与足量稀硫酸反应生成正二价金属硫酸盐和氢气,由于化合价相同,产生的氢气质量与金属的相对原子质量成反比,产生氢气质量越多,说明该金属的相对原子质量越小,则相对原子质量A<B.
故答案为:>;>;<.
由氢气质量与反应时间的关系图,等质量的两种常见金属A和B,至完全反应,A用的时间少,B用的时间多,由金属的活动性越强,与酸反应的速率越快,则金属活动性顺序A>B.
由等质量的两种常见金属A和B,分别与足量稀硫酸反应生成正二价金属硫酸盐和氢气,由于化合价相同,产生的氢气质量与金属的相对原子质量成反比,产生氢气质量越多,说明该金属的相对原子质量越小,则相对原子质量A<B.
故答案为:>;>;<.
点评:本题难度不大,掌握活动性强的金属与酸反应剧烈、在相同时间内放出氢气的速度快是正确解答本题的关键.

练习册系列答案
 尖子生新课堂课时作业系列答案
尖子生新课堂课时作业系列答案 英才计划同步课时高效训练系列答案
英才计划同步课时高效训练系列答案
相关题目
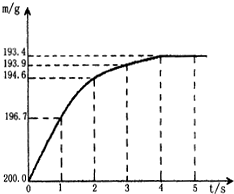 向盛有含杂质的碳酸氢钠固体(NaHCO3)20.0g的烧杯中,加入一定量的稀硫酸溶液恰好反应(杂质不反应).反应过程用精密仪器测得烧杯连同药品的质量(m)与反应时间(t)的关系如图所示.烧杯连同药品的起始质量为202.2g.反应的化学方程式为:
向盛有含杂质的碳酸氢钠固体(NaHCO3)20.0g的烧杯中,加入一定量的稀硫酸溶液恰好反应(杂质不反应).反应过程用精密仪器测得烧杯连同药品的质量(m)与反应时间(t)的关系如图所示.烧杯连同药品的起始质量为202.2g.反应的化学方程式为: 将稀盐酸滴入如图所示盛有不同物质的试管中:
将稀盐酸滴入如图所示盛有不同物质的试管中: 下列实验技能或方法都是你必须具备的,你能做出正确回答吗?
下列实验技能或方法都是你必须具备的,你能做出正确回答吗?