题目内容
【题目】(1)用化学符号填空:2个氢分子____ 碘酒中的溶剂_____
(2)中国科学家成功将二氧化碳转化为乙烯(C2H4),反应前后分子种类变化的微观示意图如图所示:
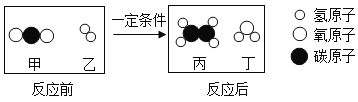
①图中所示的物质中,属于氧化物的是____(填化学式);
②该反应过程中生成的丙和丁的质量比为____。
(3)甲、乙两溶液中共有7种离子:K+、Cu2+、Ba2+、Mg2+、OH-、NO3-、SO42-。已知两溶液中所含离子各不相同,甲溶液中含有四种离子,且能使紫色石蕊试液变蓝,则乙溶液中含有的离子是___(填离子符号)。
【答案】![]()
![]()
![]() 、
、![]() 7:18
7:18 ![]() 、
、![]() 、
、![]()
【解析】
(1)氢分子的分子式为![]() ,表示分子个数直接在分子式左边写上相应的数字,则2个氢分子表示为
,表示分子个数直接在分子式左边写上相应的数字,则2个氢分子表示为![]() ;碘酒中的溶剂为酒精,化学式为
;碘酒中的溶剂为酒精,化学式为![]() 。
。
(2)根据反应前后分子种类变化的微观示意图可知,甲的分子式为![]() ,乙的分子式为
,乙的分子式为![]() ,丙的分子式为
,丙的分子式为![]() ,丁的分子式为
,丁的分子式为![]() ,反应的化学方程式为
,反应的化学方程式为 ,则有:
,则有:
①氧化物指的是由两种元素组成,其中一种为氧元素的化合物,图中所示的物质中,甲是![]() ,是由碳元素和氧元素组成的化合物,属于氧化物,乙是
,是由碳元素和氧元素组成的化合物,属于氧化物,乙是![]() ,只由一种元素组成的纯净物,属于单质,丙为
,只由一种元素组成的纯净物,属于单质,丙为![]() ,是由碳元素和氢元素组成的化合物,不属于氧化物,丁的为
,是由碳元素和氢元素组成的化合物,不属于氧化物,丁的为![]() ,是由氢元素和氧元素组成的化合物,属于氧化物,故属于氧化物的是
,是由氢元素和氧元素组成的化合物,属于氧化物,故属于氧化物的是![]() 和
和![]() ;
;
②该反应过程中生成的丙和丁的质量比为![]() 。
。
(3)由题意甲、乙两溶液中共有7种离子:K+、Cu2+、Ba2+、Mg2+、OH-、NO3-、SO42-,两溶液中所含离子各不相同,甲溶液中含有四种离子,且能使紫色石蕊试液变蓝,甲溶液中一定有![]() ,氢氧根与铜离子会形成氢氧化铜沉淀,氢氧根与镁离子会形成氢氧化镁沉淀,乙溶液中一定有铜离子和镁离子,乙溶液中含有三种离子,另一种一定是阴离子,剩下的离子中,硫酸根和钡离子会形成硫酸钡沉淀,二者不能同时存在于同一溶液中,则乙溶液中还含有硫酸根离子,综上所述乙溶液中的离子是
,氢氧根与铜离子会形成氢氧化铜沉淀,氢氧根与镁离子会形成氢氧化镁沉淀,乙溶液中一定有铜离子和镁离子,乙溶液中含有三种离子,另一种一定是阴离子,剩下的离子中,硫酸根和钡离子会形成硫酸钡沉淀,二者不能同时存在于同一溶液中,则乙溶液中还含有硫酸根离子,综上所述乙溶液中的离子是![]() 、
、![]() 、
、![]() 。
。

【题目】过氧化钠(Na2O2)是一种淡黄色固体,可用作呼吸面具中的供氧剂。某化学研究小组对过氧化钠的制备和实验室中的过氧化钠药品成分进行探究。
(查阅资料)①在点燃条件下,钠在空气中燃烧生成纯度较高的Na2O2
② 2Na2O2+2H2O = 4NaOH+O2↑ 2Na2O2+2CO2 = 2Na2CO3+O2
③金属钠遇水会发生剧烈反应生成H2
I.过氧化钠的制备
研究小组设计如图的装置进行实验室制备过氧化钠。
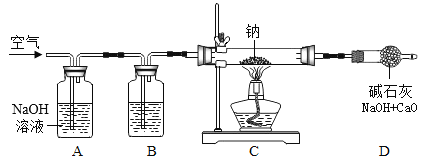
(1)装置B中的试剂是__。
(2)装置C中反应的化学方程式为__。
(3)装置D的作用是__。
II.开封已久的过氧化钠药品的成分测定
(定性检测)检测药品的成分。
(4)请补充完成下列实验报告中的相关内容。
实验序号 | 实验步骤 | 实验现象 | 解释或结论 |
① | 取少量固体样品于试管中,加入适量的水 | 样品全部溶解,无气泡产生 | 不含____ |
② | 取适量①中的溶液于试管中,加入过量的BaCl2溶液 | 有白色沉淀产生 | 化学方程式为___ |
③ | 待②充分静置后,向上层清液中滴入_____ | ____ | 含有氢氧化钠 |
(定量检测)检测药品的组成。
实验④:称取9.30g开封已久的过氧化钠样品于试管中,加入足量的稀硫酸,将产生的气体全部鼓入到足量的澄清石灰水中,过滤、洗涤、干燥,得到碳酸钙固体5.00g。
(5)计算确定样品中氢氧化钠的质量分数_____(写出计算过程,计算最后结果精确到0.1%)。
【题目】为了探究碳与氧化铜反应的气体产物中是否有一氧化碳,某同学进行如下实验过程。(装置B和D内均是足量澄清石灰水)

①A处加热一段时间后,试管中的现象是_______。
②B处石灰水变浑浊,其反应的化学方程式是______,
③若能说明A处反应的气体产物中有一氧化碳,依据的一个现象是_____。
为进一步确定碳与氧化铜反应产生一氧化碳的质量,该同学测量了如下数据:
A处 试管内物质 | B处 瓶内物质 | C处 玻璃管内物质 | D处 瓶内物质 | |
反应前后质量变化量 (g) | a | b | c | d |
则一氧化碳的质量m(CO)=____________。(用上述字母表达)
④停止实验,待C处玻璃管冷却,倒出固体于试管中,加入足量稀硫酸,看到____现象,则推出固体的成分是氧化铜和铜。