题目内容
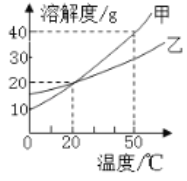
【题目】恒温蒸发某物质的溶液,现象如图所示,说法正确的是
A.①②都是不饱和溶液
B.溶质质量分数的大小:①<②<③<④
C.溶质的质量:①=②>③>④
D.该物质的溶解度随温度升高而变大
【答案】C
【解析】
A、蒸发前的烧杯底部没有固体,第二次蒸发水,析出晶体,则乙溶液可能饱和也可能不饱和,而甲溶液一定不饱和,选项错误;
B、①②中溶质、溶剂的量都相同,溶质的质量分数相等;③④都是该温度下的饱和溶液,溶质的质量分数也相等,但比①②的溶质质量分数大,溶质质量分数的大小:①=②<③=④,选项错误;
C、①②中固体都完全溶解,溶质的质量相等,③④中有固体剩余,且④比③固体多,溶质的质量:①=②>③>④,选项正确;
D、实验中溶液的温度没有改变,不能说明该物质的溶解度随温度升高而增大,选项错误。
故选C。

【题目】实验室制取气体时常要考虑下列问题:
(1)选择合理的制取装置。
用如下图所示装置制取气体,请回答下列问题。

①仪器a的名称是__。
②选用A加热KMnO4制O2,装置需要改进的地方是__,反应的化学方程式为__。
③实验室用Zn和稀硫酸制取H2的化学方程式为__。
④实验室可用亚硝酸钠(NaNO2)和NH4Cl的饱和溶液加热法制备N2,应选择的发生装置和收集装置的组合是__(写出一种组合,填序号)。
(2)检验、除杂和尾气处理。
①通过饱和NaHCO3溶液洗气,可除去CO2中的HCl。洗气时化学反应方程式为__。
②实验室制备下列气体时,一般需要进行尾气处理的是__(填序号)。
a H2 b CO c CO2 d SO2
(3)反应装置的改进和反应条件的探究。
某实验小组为了探究影响H2O2分解制取氧气快慢的因素,进行了下列实验:
实验序号 | H2O2溶液的质量分数/% | H2O2溶液的体积/ml | 温度/℃ | MnO2粉末的用量/g | 收集气体的体积/ml | 收集气体所需的时间/s |
A | 5 | 1 | 20 | 0.1 | 4 | a |
B | 15 | 1 | 20 | 0.1 | 4 | b |
C | 30 | 5 | 35 | 0.1 | 4 | c |
D | 30 | 5 | 55 | 0.1 | 4 | d |
①欲探究温度对H2O2分解快慢的影响,应该选择的对照实验组是__(填实验序号)。
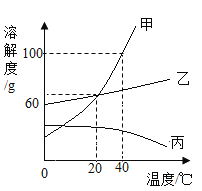
②该小组利用如下左图所示装置探究MnO2质量对H2O2分解快慢的影响:在三份8.0ml3%的H2O2溶液中分别加入0.03g、0.06g和0.08gMnO2粉末,获得实验数据如下右图所示(温度变化忽略不计,产生氧气的体积与装置内的压强成正比)。通过对曲线图的分析,将推理得出的结论填写在下列空白中。

结论I:在其他条件不变的情况下,所用MnO2质量越大,H2O2的分解速率__。
结论II:在其他条件不变的情况下,所用MnO2质量越大,生成氧气的总量__。
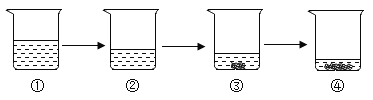
【题目】如图所示,将液体X加入到集气瓶中与固体Y作用,观察到气球逐渐变大,如表中液体X和固体Y的组合,符合题意的是( )
① | ② | ③ | ④ | ⑤ | |
X | 稀盐酸 | 水 | 水 | 双氧水 | 水 |
Y | 铁粉 | 氢氧化钠 | 氯化钠 | 二氧化锰 | 硝酸铵 |
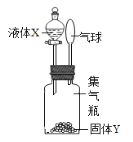
A. ①②⑤ B. ①③④ C. ①②④ D. ②③⑤
【题目】某同学对硝酸钾和固体 X(不含结晶水)的溶解度进行研究
①硝酸钾的部分溶解度见下表。20℃时,硝酸钾的溶解度是_____g/100g 水
温度(℃) | 0 | 20 | 40 | 60 | 80 | 100 |
溶解度(g/100g 水) | 13.3 | 31.6 | 63.9 | 110 | 169 | 246 |
②如下图所示,将硝酸钾、固体 X 各 156g 分别放入 100g 水中;固体均全部溶解形成 80℃的 A、B 两份溶液且溶液 B 恰好饱和
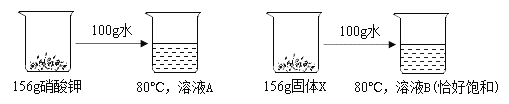
Ⅰ.80℃时,固体 X 的溶解度是 ___g/100g 水
Ⅱ. 溶液 A 和溶液 B 的溶质质量分数的大小关系是:A__B(选填“=”“>”或“<”)
Ⅲ.将溶液 A、B 分别降低温度,不同温度时析出晶体的总质量记录如下:
温度(℃) | 60 | 40 | 30 | 20 | 10 |
溶液 A 析出晶体的总质量(g) | 46 | 92.1 | m1 | m2 | m3 |
溶液 B 析出晶体的总质量(g) | 40 | 77.4 | 94.7 | 108.9 | 123.6 |
根据上述数据
两种物质溶解度相等的最小温度范围是___; 10℃时,硝酸钾与 X 的溶解度的大小关系是:S(硝酸钾)____S(X)(选填“=”“>”或“<”)