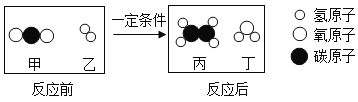
题目内容
【题目】我国青海湖地区有一种做法,冬天捞碱(Na2CO3),夏天晒盐(NaCI)。化学小组的同学们也到盐湖捞了一些“碱”,回到实验室测定碳酸钠的含量。同学们取样品24克于烧杯中,向样品中逐滴加入稀盐酸,当加入稀盐酸的质量为100g时,恰好完全反应。此时烧杯中物质的质量为115.2g(提示:Na2CO3+2HCl=2NaCl+H2O+CO2↑,杂质只有食盐(NaCl)。请计算:
(1)反应生成二氧化碳的质量?
(2)样品中含碳酸钠的质量分数?
(3)完全反应时所得溶液(烧杯内无固体)中溶质的质量分数?
【答案】(1)8.8g (2)88.3% (3)22.7%
【解析】
(1)由题意得生成的CO2质量为![]() ;
;
(2)设参与反应的碳酸钠质量为x,反应产生的NaCl质量为y,则有:
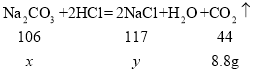
![]()
![]() ,
,
![]()
![]() ,
,
样品中含碳酸钠的质量分数:![]() ,
,
完全反应时所得溶液(烧杯内无固体)中溶质的质量分数为:![]() ,
,
答:(1)反应生成的CO2质量为88g,
(2)样品中含Na2CO3的质量分数为88.3%,
(3)完全反应时所得溶液(烧杯内无固体)中溶质的质量分数为22.7%。

 精英口算卡系列答案
精英口算卡系列答案 应用题点拨系列答案
应用题点拨系列答案【题目】请从A~D中任选三个作答,若均作答,按前三个计分。如图,在Y形管中进行实验。补全实验方案。
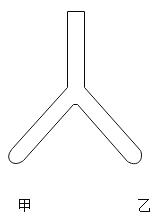
序号 | 目的 | 操作 | 现象 | 结论 |
A | 探究金属活动性 | 甲:放入铁片; 乙:放入银片; 向甲、乙处加入________ | 甲中有红色固体生成,溶液变为浅绿色; 乙中无明显变化 | 金属活动性:铁>铜> 银 |
B | 验证可燃物的燃烧条件 | 甲:放入红磷; 乙:放入白磷; 将甲、乙底部浸入80°C热水中 | 甲中无明显变化; 乙中白磷燃烧 | ________ |
C | 探究CO2的性质 | 甲:放入干燥的石蕊纸条; 乙:放入湿润的石蕊纸条; 向甲、乙处倒入CO2 | ________ | 二氧化碳能与水反应 |
D | 比较________ | 甲:放入一小粒高锰酸钾; 乙:放入一小粒碘; 向甲、乙处加入等量蒸馏水 | 甲中固体溶解形成紫色溶液; 乙中固体几乎不溶解 | 相同条件下,高锰酸钾在水中的溶解能力比碘强 |
【题目】实验室制取气体时常要考虑下列问题:
(1)选择合理的制取装置。
用如下图所示装置制取气体,请回答下列问题。

①仪器a的名称是__。
②选用A加热KMnO4制O2,装置需要改进的地方是__,反应的化学方程式为__。
③实验室用Zn和稀硫酸制取H2的化学方程式为__。
④实验室可用亚硝酸钠(NaNO2)和NH4Cl的饱和溶液加热法制备N2,应选择的发生装置和收集装置的组合是__(写出一种组合,填序号)。
(2)检验、除杂和尾气处理。
①通过饱和NaHCO3溶液洗气,可除去CO2中的HCl。洗气时化学反应方程式为__。
②实验室制备下列气体时,一般需要进行尾气处理的是__(填序号)。
a H2 b CO c CO2 d SO2
(3)反应装置的改进和反应条件的探究。
某实验小组为了探究影响H2O2分解制取氧气快慢的因素,进行了下列实验:
实验序号 | H2O2溶液的质量分数/% | H2O2溶液的体积/ml | 温度/℃ | MnO2粉末的用量/g | 收集气体的体积/ml | 收集气体所需的时间/s |
A | 5 | 1 | 20 | 0.1 | 4 | a |
B | 15 | 1 | 20 | 0.1 | 4 | b |
C | 30 | 5 | 35 | 0.1 | 4 | c |
D | 30 | 5 | 55 | 0.1 | 4 | d |
①欲探究温度对H2O2分解快慢的影响,应该选择的对照实验组是__(填实验序号)。
②该小组利用如下左图所示装置探究MnO2质量对H2O2分解快慢的影响:在三份8.0ml3%的H2O2溶液中分别加入0.03g、0.06g和0.08gMnO2粉末,获得实验数据如下右图所示(温度变化忽略不计,产生氧气的体积与装置内的压强成正比)。通过对曲线图的分析,将推理得出的结论填写在下列空白中。

结论I:在其他条件不变的情况下,所用MnO2质量越大,H2O2的分解速率__。
结论II:在其他条件不变的情况下,所用MnO2质量越大,生成氧气的总量__。
【题目】如图所示,将液体X加入到集气瓶中与固体Y作用,观察到气球逐渐变大,如表中液体X和固体Y的组合,符合题意的是( )
① | ② | ③ | ④ | ⑤ | |
X | 稀盐酸 | 水 | 水 | 双氧水 | 水 |
Y | 铁粉 | 氢氧化钠 | 氯化钠 | 二氧化锰 | 硝酸铵 |
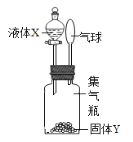
A. ①②⑤ B. ①③④ C. ①②④ D. ②③⑤