题目内容
【题目】酸、碱、盐是几类重要的化合物,他们之间能发生复分解反应。
(1)复分解反应发生的条件是有沉淀析出,或有气体放出,或有_____生成。
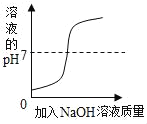
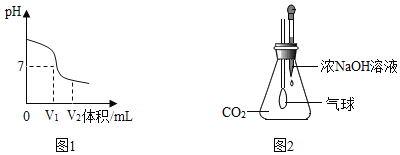
(2)图1是氢氧化钠溶液与硫酸反应时溶液pH变化的示意图。
①根据图示判断,该实验是将_____(填“氢氧化钠溶液”或“硫酸”)滴加到另一种溶液中。
②写出该反应的化学方程式_____。
③滴入溶液体积为V2mL时,溶液中的溶质为_____。
(3)图2是某趣味实验装置图。挤压胶头滴管后,可观察到气球胀大的现象。
①请分析其原因,并写出化学方程式_____。
②如何验证反应后溶液中含有的两种溶质。(请简要写出实验步骤及现象)_____。
【答案】水 硫酸 2NaOH+H2SO4=Na2SO4+2H2O Na2SO4、H2SO4 二氧化碳被浓NaOH溶液吸收,锥形瓶内的气压减小,外界大气压大于锥形瓶内的气压,使气球胀大。化学方程式为:2NaOH+CO2═Na2CO3+H2O 取反应后的少量溶液于试管中,先加入足量的CaCl2溶液,有白色沉淀产生,说明原溶液中含有碳酸钠,静置,取上层清液滴加无色酚酞,溶液变红色,说明原溶液中含有氢氧化钠
【解析】
(1)复分解反应发生的条件是有沉淀析出,或有气体放出,或有水生成;
(2)①由于滴加药品的过程中,pH在变小,所以该实验是将硫酸滴加到另一种溶液中;
②硫酸与氢氧化钠发生中和反应生成硫酸钠和水;反应的化学方程式:2NaOH+H2SO4=Na2SO4+2H2O;
③滴入溶液体积为V2mL时,此时pH小于7,说明硫酸过量,溶液中的溶质为生成的硫酸钠和过量的硫酸;
(3)①氢氧化钠溶液能与二氧化碳反应生成碳酸钠和水,而使瓶内的气体被消耗,压强变小,气球变大,所以原因是:二氧化碳被浓NaOH溶液吸收,锥形瓶内的气压减小,外界大气压大于锥形瓶内的气压,使气球胀大,化学方程式为:2NaOH+CO2═Na2CO3+H2O;
②碳酸钠溶液与氢氧化钠溶液均显碱性,氢氧化钠与氯化钙不反应,而碳酸钠能与氯化钙反应生成碳酸钙白色沉淀和氯化钠,所以检验反应后溶液中含有的两种溶质的方法是取反应后的少量溶液于试管中,先加入足量的CaCl2溶液,有白色沉淀产生,说明原溶液中含有碳酸钠,静置,取上层清液滴加无色酚酞,溶液变红色,说明原溶液中含有氢氧化钠。

 孟建平名校考卷系列答案
孟建平名校考卷系列答案