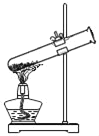
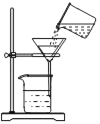
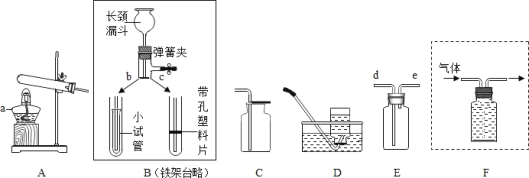
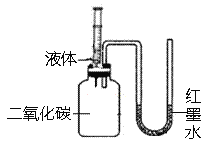
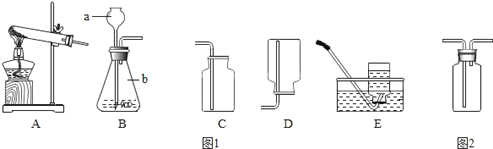
题目内容
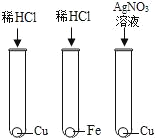
【题目】图是常见物质的转化关系,其中X的浓溶液能挥发出剌激性气味的气体,A﹣D 的反应过程中有蓝色沉淀生成,E为白色沉淀。部分反应物、生成物及反应条件已省略。

(1)B的化学式为_____。
(2)写出X﹣D的化学方程式_____
(3)E的化学式为_____。X与AgNO3反应后所得溶液的pH_____7(选填“大于”小于或“等于”)。
【答案】FeCl2 NaOH+HCl=NaCl+H2O AgCl 小于。
【解析】
(1)根据A﹣G是初中化学常见物质,X的浓溶液能挥发出刺激性气味的气体,X和铁粉、氢氧化钠会反应,所以X是盐酸;从A→D的反应过程中有蓝色沉淀生成,依据复分解反应原理可知A中含有铜离子,A就是CuCl2,2NaOH+CuCl2 =2NaCl+ Cu(OH)2↓,Cu(OH)2是蓝色沉淀,NaOH+HCl =NaCl +H2O,所以D是NaCl,Fe+CuCl2=Cu+FeCl2,Fe+2HCl=FeCl2+H2↑,所以B是FeCl2,E为白色沉淀,X、B、D中都含有氯离子,和硝酸银反应会生成白色沉淀,所以E是AgCl,经过验证,推出的各种物质均满足题中的转化关系,推导合理,所以X是HCl,E是AgCl,B是FeCl2;
(2)X﹣D即盐酸和氢氧化钠的反应,化学方程式为NaOH+HCl=NaCl+H2O。
(3)根据分析,E的化学式为 AgCl.X与AgNO3反应,即稀盐酸与硝酸银溶液反应,HCl+ AgNO3=AgCl↓+HNO3,硝酸显酸性,故反应后所得溶液的pH<7。

【题目】如表格是甲乙丙三种物质在不同温度下的溶解度(单位g),如图是KNO3、NaCl两种固体的溶解度曲线,请结合表格和曲线回答下列问题
0℃ | 30℃ | 60℃ | 90℃ | |
甲 | 13.3 | 45.8 | 110 | 202 |
乙 | 35.5 | 36.0 | 37.1 | 38.1 |
丙 | 0.18 | 0.16 | 0.12 | 0.08 |
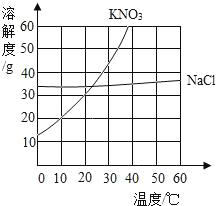
(1)甲、乙、丙三种物质中可能是硝酸钾的是_____;
(2)欲使30℃时丙的饱和溶液转化为不饱和溶液,除加溶剂外还可以采取的方法是_____;
(3)在30℃时,将50g甲放入100g水中,充分搅拌。所得溶液的质量约为_____g,将此混合物升温到90℃时,以下说法正确的是_____
A 甲的溶解度变大 B 甲溶液的质量变大 C 溶液中甲的质量分数不变
(4)KNO3中混有少量NaCl,提纯KNO3采取_____结晶方法。