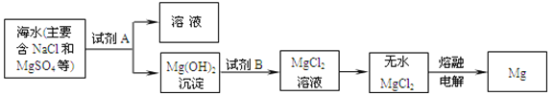
题目内容
【题目】能源、材料、环保、食品、安全等问题越来越引起人们的重视。请从化学的视角分析下列有关问题并填空:
(1)很多城市的公共交通工具使用了压缩天然气(CNG)作为燃料,写出天然气主要成分甲烷燃烧的化学方程式:_______。
(2)铁路建设需要大量的钢铁,钢铁属于_______(填“合成材料”“金属材料”或“复合材料”)。
(3)建设“美丽中国”离不开优美的环境。硝酸工厂排放的尾气中常含有NO、NO2等有害气体,可用氢氧化钠溶液来吸收:![]() 。X的化学式为:________。
。X的化学式为:________。
(4)为了合理膳食,生活中把榨好的蔬菜汁放到面粉中,做成口味独特、营养丰富的蔬菜馒头。这种馒头提供的营养素主要有______(任写一种)。
(5)实验时不慎打翻燃着的酒精灯,应立即________。
【答案】 金属材料 NaNO2 糖类(或淀粉) 用湿抹布扑盖
金属材料 NaNO2 糖类(或淀粉) 用湿抹布扑盖
【解析】
(1)天然气的主要成分是甲烷,甲烷在空气中燃烧生成二氧化碳和水,其化学反应方程式为: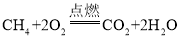 ;
;
(2)铁路建设需要大量的钢铁,钢铁属于金属材料;
(3)![]() ,根据质量守恒定律,化学反应前后,原子的种类和数目不变,故X的化学式为NaNO2;
,根据质量守恒定律,化学反应前后,原子的种类和数目不变,故X的化学式为NaNO2;
(4)把榨好的蔬菜汁放到面粉里做成蔬菜馒头,这种馒头提供的营养素有糖类、维生素等;
(5)实验室不慎打翻燃着的酒精灯,应用湿布盖灭,隔绝空气,同时降低温度至着火点以下,达到灭火的目的。

 浙大优学小学年级衔接捷径浙江大学出版社系列答案
浙大优学小学年级衔接捷径浙江大学出版社系列答案【题目】某化学兴趣小组为了测定某石灰石样品中碳酸钙的质量分数,取用2.0g石灰石样品,把25.0g一定溶质质量分数的稀盐酸分五次加入样品中(样品中的杂质既不与盐酸反应,也不溶解于水),每次充分反应后都经过滤、洗涤、干燥、称量,得到实验数据如下;
实验次数 | 1 | 2 | 3 | 4 | 5 |
稀盐酸的累计加入量/g | 5.0 | 10.0 | 15.0 | 20.0 | 25.0 |
剩余固体的质量g | 1.5 | 1.0 | 0.5 | 0.3 | 0.3 |
请计算:
(1)石灰石样品中碳酸钙的质量分数_____。
(2)所用稀盐酸中溶质的质量分数。_____(要求写出计算的过程)
【题目】以下是某研究小组探究影响反应速率部分因素的相关实验数据。
实验序号 | H2O2溶液浓度% | H2O2溶液体积/mL | 温度/℃ | MmO2的用量/g | 收集氧气的体积/mL | 反应所需的时间/s |
① | 5 | 1 | 20 | 0.1 | 4 | 16.75 |
② | 15 | 1 | 20 | 0.1 | 4 | 6.04 |
③ | 30 | 5 | 35 | 0 | 2 | 49.21 |
④ | 30 | 5 | 55 | 0 | 2 | 10.76 |
(1)通过实验①和②对比可知,化学反应速率与_____有关;从实验_____和_____对比可知,化学反应速率与温度的关系是:_____;
(2)化学反应的实质是微观粒子相互接触、碰撞的结果,化学反应速率与微观粒子的概率有关。试从微观角度解释“反应物浓度越大,化学反应速率越快”的原因是:_____;
(3)用一定量15%的过氧化氢溶液制氧气,为了减小反应速率,可加适量的水稀释,产生氧气的总重量_____(选填“减小“或“不变“或“增大”);
(4)写出上述反应文字表达式_____。