题目内容
【题目】我国有较长的海岸线,海洋资源十分丰富。
(1)海水晒盐可获得粗盐,在实验室中粗盐经过溶解、过滤、_____可制得精盐。
(2)目前世界上60%的镁是从海水中提取的。其主要步骤如下:
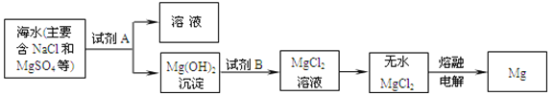
①提取Mg的过程中,写一个选用试剂A发生反应的化学方程式_____,试剂B与Mg(OH)2发生反应的化学方程式为_____,由无水MgCl2熔融电解制取Mg的过程中,质量减轻了7.1t,则生成了Mg多少_____t。
②分离出Mg(OH)2后的NaCl溶液中还含有CaCl2、Na2SO4等杂质,为了获得NaCl溶液,在分离后的溶液中依次加入过量的BaCl2溶液和Na2CO3溶液,过滤,再向滤液中加入适量盐酸。在此过程中加入过量Na2CO3溶液的目的是_____。
③海底矿产资源“可燃冰”,其主要成分是水合甲烷晶体(CH4·nH2O)。若水合甲烷晶体中CH4的质量分数为10%,则水合甲烷晶体的化学式为_____。
【答案】蒸发 ![]() (或KOH合理就可)
(或KOH合理就可) ![]() 2.4 除去CaCl2和过量的BaCl2 CH4·8H2O
2.4 除去CaCl2和过量的BaCl2 CH4·8H2O
【解析】
(1)在实验室中粗盐经过溶解、过滤、蒸发后可制得精盐;
(2)①试剂A可以是氢氧化钠,其和硫酸镁反应生成硫酸钠和氢氧化镁沉淀,反应的化学方程式为![]() ;
;
②由无水MgCl2熔融电解制取Mg,反应生成Mg和Cl2,减少的质量即为Cl2的质量,设生成了Mg的质量为x,计算过程如下:
 ,
,
![]() ,解得x=2.4t,故生成了Mg的质量为2.4t;
,解得x=2.4t,故生成了Mg的质量为2.4t;
溶液中含有杂质CaCl2以及过量的BaCl2,故加入过量Na2CO3溶液的目的是除去CaCl2和过量的BaCl2;
③水合甲烷晶体的化学式为CH4·nH2O,水合甲烷晶体中CH4的质量分数为10%,故可得![]() ,解得n=8,故水合甲烷晶体的化学式为CH4·8H2O。
,解得n=8,故水合甲烷晶体的化学式为CH4·8H2O。

 智趣寒假作业云南科技出版社系列答案
智趣寒假作业云南科技出版社系列答案