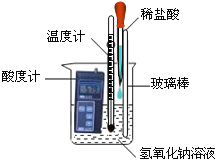
题目内容
【题目】完成下列实验。
⑴以下是小阳同学实验室制取气体的实验过程,请根据题意回答问题。
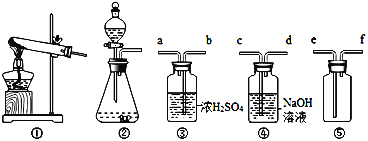
1)如果他用过氧化氢制取并收集氧气,可以选择的装置是______(填序号);如果他选用装置①来制取氧气,则其化学反应方程式为_________。
2)若要制得干燥的二氧化碳,同时避免多余的二氧化碳逸散到空气中,则装置按导管字母连接的顺序是:发生装置→_____→______→______→_______→______(填字母)。
3)图中的⑤装置是用排空气法收集氢气的装置,请你判断气体应由_______进入(填字母)。
⑵同学们需要7.5g食盐和42.5mL水用于实验,如图为实验操作过程:
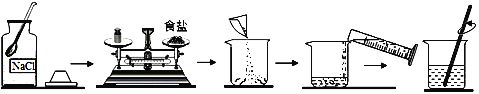
1)称取7.5g食盐时,1g以下需要移动游码,若按如图操作,天平平衡时,实际称得的药品质量________(填“偏大”“偏小”“不变”)。
2)按正确操作称取食盐时,发现指针偏向右测,应如何操作______。
A.减少砝码 B.增加食盐 C.调节平衡螺母
3)需要量取42.5mL水,量筒的规格应选择(20、50、100)______mL。
4)经检测,配制出来的NaCl溶液溶质质量分数偏小,其原因可能有________(填序号)。
①氯化钠固体不纯 ②称好的食盐有部分洒落到烧杯外
③量取水时,仰视读数 ④装瓶时,有少量溶液洒出
【答案】②⑤ 2KClO3![]() 2KCl+3O2↑ b a e f c f 偏小 B 50 ①②③
2KCl+3O2↑ b a e f c f 偏小 B 50 ①②③
【解析】
⑴ 1)如果用过氧化氢制取并收集氧气,选择固液常温型装置,故选②;选用装置①来制取氧气,是用氯酸钾制取氧气,其化学反应方程式为:2KClO3![]() 2KCl + 3O2↑。2)浓硫酸具有吸水性,可干燥二氧化碳,装置③是洗气装置,气体长进短出。吸收二氧化碳用氢氧化钠溶液,由于二氧化碳的密度比空气的密度大,用排空气法收集二氧化碳,长导气管是进气管。所以若要制得干燥的二氧化碳,同时避免多余的二氧化碳逸散到空气中,则装置按导管字母连接的顺序是:发生装置→b→a→e→f→c。3)氢气的密度比空气的密度小,如果用图中的⑤装置是用排空气法收集氢气,由于氢气进入以后占据上方空间,空气被赶到下方空间而从e端排出,则氢气从f端进入。
2KCl + 3O2↑。2)浓硫酸具有吸水性,可干燥二氧化碳,装置③是洗气装置,气体长进短出。吸收二氧化碳用氢氧化钠溶液,由于二氧化碳的密度比空气的密度大,用排空气法收集二氧化碳,长导气管是进气管。所以若要制得干燥的二氧化碳,同时避免多余的二氧化碳逸散到空气中,则装置按导管字母连接的顺序是:发生装置→b→a→e→f→c。3)氢气的密度比空气的密度小,如果用图中的⑤装置是用排空气法收集氢气,由于氢气进入以后占据上方空间,空气被赶到下方空间而从e端排出,则氢气从f端进入。
⑵ 1)使用托盘天平称量药品,左物右码,放反以后,被称药品的质量=砝码质量-游码质量,所以实际称量药品的质量=7.0g-0.5g=6.5g,比实际质量偏小。2)按正确操作称取食盐时,发现指针偏向右测,说明砝码质量重,则药品的质量不足7.5g,所以应该添加食盐。3)量筒量程选择的依据有两点,一是保证测量一次,二是应选择量程与液体的取用量最接近,所以量取42.5mL水,应选择50mL的量筒。4)经检测,配制出来的NaCl溶液溶质质量分数偏小,其原因可能是称量的NaCl偏少或量取的水偏多。①氯化钠固体不纯,则实际氯化钠的质量偏少,使配制出来的NaCl溶液溶质质量分数偏小,此选项符合题意;②称好的食盐有部分洒落到烧杯外,则溶解于水的食盐偏少,使配制出来的NaCl溶液溶质质量分数偏小,此选项符合题意;③量取水时,仰视读数,量取的水偏多,使配制出来的NaCl溶液溶质质量分数偏小,此选项符合题意;④溶液具有均一性,装瓶时,有少量溶液洒出,不影响配制出来的NaCl溶液溶质质量分数,此选项不符合题意。故选①②③。

 智慧小复习系列答案
智慧小复习系列答案【题目】某化学兴趣小组在实验室用氯酸钾与二氧化锰的固体混合物,加热制取氧气时,发现制得的气体有刺激性气味,于是在老师的指导下对该气体成分进行探究。
(提出问题)氯酸钾与二氧化锰混合加热后产生的气体是什么?
(查阅资料)
①氯酸钾与二氧化锰混合加热产生的气体只以单质形式存在;
②氯气Cl是黄绿色、有刺激性气味的气体,能溶于水并能与水反应生成盐酸和次氯酸(HClO),能使湿润的淀粉碘化钾试纸变蓝。
(猜想与假设)
猜想一:该气体为O2;猜想二:该气体为Cl2;猜想三:该气体为______。
(实验探究)
序号 | 实验操作 | 实验现象 | |
① | 用排水法收集A、B两瓶气体,将带火星木条伸入A中,湿润的淀粉碘化钾试纸伸入B中 | A中带火星木条复燃,B中淀粉碘化钾试纸______。 | 猜想一成立 |
② | 用向上排空气法收集C、D两瓶气体,将带火星木条伸入C中,湿润的淀粉碘化钾试纸伸入D中 | C中带火星木条复燃,D中湿润的淀粉碘化钾试纸变蓝 | 猜想____成立 |
(反思与评价)有同学认为实验①的结论不正确,原因是用排水法收集气体时,氯气会溶于水并与水发生反应,氯气与水反应的化学方程式为______。
(拓展应用)
(1)二氧化锰不仅能做催化剂,还可以做反应物,实验室常用二氧化锰与浓盐酸共热制取氯气,该反应的化学方程式为MnO2+4HCl(浓)![]() MnCl2+2H2O+Cl2↑,MnO2中锰元素的化合价为______。
MnCl2+2H2O+Cl2↑,MnO2中锰元素的化合价为______。
(2)该反应进行一小段时间后就不再产生气泡,此时反应物还大量存在,兴趣小组同学猜想是盐酸浓度变小了,造成反应停止,请设计实验方案证明该猜想是否正确______。
(注意:若答对以下小题奖励4分,化学试卷总分不超过60分。)
(3)将(1)中反应后的物质过滤,向滤液中滴加5%的过氧化氢溶液,发现产生大量气泡,一段时间后用带火星的木条检验木条复燃。滤液中的什么物质催化了过氧化氢分解,提出猜想并设计实验方案验证(不写出现象及结论)。
猜想一:______;猜想二:______;
设计实验:______。
【题目】以下是某研究小组探究影响反应速率部分因素的相关实验数据。
实验序号 | H2O2溶液浓度% | H2O2溶液体积/mL | 温度/℃ | MmO2的用量/g | 收集氧气的体积/mL | 反应所需的时间/s |
① | 5 | 1 | 20 | 0.1 | 4 | 16.75 |
② | 15 | 1 | 20 | 0.1 | 4 | 6.04 |
③ | 30 | 5 | 35 | 0 | 2 | 49.21 |
④ | 30 | 5 | 55 | 0 | 2 | 10.76 |
(1)通过实验①和②对比可知,化学反应速率与_____有关;从实验_____和_____对比可知,化学反应速率与温度的关系是:_____;
(2)化学反应的实质是微观粒子相互接触、碰撞的结果,化学反应速率与微观粒子的概率有关。试从微观角度解释“反应物浓度越大,化学反应速率越快”的原因是:_____;
(3)用一定量15%的过氧化氢溶液制氧气,为了减小反应速率,可加适量的水稀释,产生氧气的总重量_____(选填“减小“或“不变“或“增大”);
(4)写出上述反应文字表达式_____。