题目内容
 某化学课外活动小组用石灰石和稀盐酸为原料制取二氧化碳,在完成实验后,对反应后的废液进行探究.他们取过滤后的废液100g,向其中逐渐滴加溶质的质量分数为10%的Na2CO3溶液,烧杯中溶液的质量与所滴入Na2CO3溶液的质量关系如图所示:
某化学课外活动小组用石灰石和稀盐酸为原料制取二氧化碳,在完成实验后,对反应后的废液进行探究.他们取过滤后的废液100g,向其中逐渐滴加溶质的质量分数为10%的Na2CO3溶液,烧杯中溶液的质量与所滴入Na2CO3溶液的质量关系如图所示:
请根据题意回答下列问题:
(1)在实验过程中,有气体放出,还可以看到的明显实验现象是________,由此得出过滤后的废液中含有的溶质为________.(填化学式)
(2)在实验过程中放出气体的总质量是________g.
(3)当滴入Na2CO3溶液至图中B点时,求此时所得不饱和溶液中溶质的质量.
解:(1)制取二氧化碳反应后的废液,滴加Na2CO3溶液,有气体放出,说明废液中有HCl;当Na2CO3溶液过量时,碳酸钠和氯化钙反应产生碳酸钙生白色沉淀;由此可知废液中含有的溶质为:CaCl2;HCl;
故答案为:产生白色沉淀;CaCl2、HCl;
(2)设实验过程中放出气体的总质量为a
Na2CO3+2HCl=2NaCl+CO2↑+H2O
106 44
106g×10% a
 =
=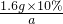 解答 a=4.4g
解答 a=4.4g
故答案为:4.4g;
(3)解:106g10%的碳酸钠溶液中含 Na2CO3 的质量是:106g×10%=10.6g
设反应进行至 A点时生成的氯化钠的质量为 x,
Na2CO3+2HCl=2NaCl+CO2↑+H2O
106 117
10.6g x
 =
=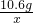 x=11.7g
x=11.7g
由 A点进行至 B 点滴加碳酸钠的质量:(212g-106g)×10%=10.6g
设反应由 A 点进行至 B 点时生成的氯化钠的质量为 y,
Na2CO3+CaCl2=2NaCl+CaCO3↓
106 117
10.6g y
 =
=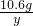 y=11.7g
y=11.7g
烧杯里不饱和溶液中溶质的质量为:11.7g+11.7g=23.4g
答:烧杯里不饱和溶液中溶质的质量为 23.4g.
分析:(1)制取二氧化碳反应后的废液,滴加Na2CO3溶液,有气体放出,说明废液中有HCl;当Na2CO3溶液过量时,碳酸钠和氯化钙反应产生碳酸钙生白色沉淀;进行解答;
(2)根据图示数据,10%的Na2CO3溶液的质量计算放出气体的总质量;
(3)根据图示数据,分别计算出A点 Na2CO3 与HCl生成氯化钠的质、B点Na2CO3 与 CaCl2 生成氯化钠的质量,即可解答.
点评:本题主要考查学生运用所学化学知识综合分析和解决实际问题的能力.增加了学生分析问题的思维跨度,强调了学生整合知识的能力.
故答案为:产生白色沉淀;CaCl2、HCl;
(2)设实验过程中放出气体的总质量为a
Na2CO3+2HCl=2NaCl+CO2↑+H2O
106 44
106g×10% a
 =
=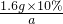 解答 a=4.4g
解答 a=4.4g故答案为:4.4g;
(3)解:106g10%的碳酸钠溶液中含 Na2CO3 的质量是:106g×10%=10.6g
设反应进行至 A点时生成的氯化钠的质量为 x,
Na2CO3+2HCl=2NaCl+CO2↑+H2O
106 117
10.6g x
 =
=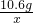 x=11.7g
x=11.7g 由 A点进行至 B 点滴加碳酸钠的质量:(212g-106g)×10%=10.6g
设反应由 A 点进行至 B 点时生成的氯化钠的质量为 y,
Na2CO3+CaCl2=2NaCl+CaCO3↓
106 117
10.6g y
 =
=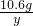 y=11.7g
y=11.7g 烧杯里不饱和溶液中溶质的质量为:11.7g+11.7g=23.4g
答:烧杯里不饱和溶液中溶质的质量为 23.4g.
分析:(1)制取二氧化碳反应后的废液,滴加Na2CO3溶液,有气体放出,说明废液中有HCl;当Na2CO3溶液过量时,碳酸钠和氯化钙反应产生碳酸钙生白色沉淀;进行解答;
(2)根据图示数据,10%的Na2CO3溶液的质量计算放出气体的总质量;
(3)根据图示数据,分别计算出A点 Na2CO3 与HCl生成氯化钠的质、B点Na2CO3 与 CaCl2 生成氯化钠的质量,即可解答.
点评:本题主要考查学生运用所学化学知识综合分析和解决实际问题的能力.增加了学生分析问题的思维跨度,强调了学生整合知识的能力.

练习册系列答案
相关题目
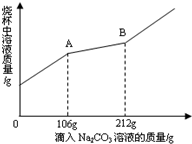 某化学课外活动小组用石灰石和稀盐酸为原料制取二氧化碳,在完成实验后,对反应后的废液进行探究.他们取过滤后的废液100g,向其中逐渐滴加溶质的质量分数为10%的Na2CO3溶液,烧杯中溶液的质量与所滴入Na2CO3溶液的质量关系如图所示:
某化学课外活动小组用石灰石和稀盐酸为原料制取二氧化碳,在完成实验后,对反应后的废液进行探究.他们取过滤后的废液100g,向其中逐渐滴加溶质的质量分数为10%的Na2CO3溶液,烧杯中溶液的质量与所滴入Na2CO3溶液的质量关系如图所示:
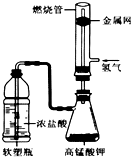 某化学课外活动小组用如图所示的装置制取氯气(Cl2)并模拟盐酸工业合成氯化氢(金属网用以防止气体在燃烧过程中发生爆炸).
某化学课外活动小组用如图所示的装置制取氯气(Cl2)并模拟盐酸工业合成氯化氢(金属网用以防止气体在燃烧过程中发生爆炸).