题目内容
同学们在实验室进行“二氧化碳的性质与制取”实验.请结合如图所示回答问题.
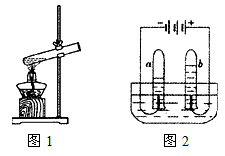
(1)制取二氧化碳:
①反应物应选择
②发生装置选择:
③经检查装置气密性良好后,装入药品开始实验.二氧化碳可用
(2)如图C所示,在甲、乙两支试管中分别装有相同质量相同浓度的澄清石灰水,用针管不断向甲试管石灰水中注入空气,通过导管向乙试管石灰水中不断吹气.实验发现,乙试管内的澄清石灰水先变浑浊.该实验能否说明人呼出的气体中二氧化碳浓度大于空气中的二氧化碳浓度?为什么
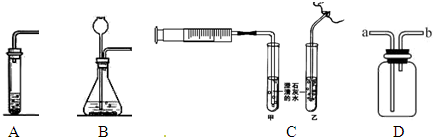
(3)实验室用无水醋酸钠和碱石灰两种固体混合共热制取甲烷气体,用硫化亚铁固体与稀硫酸制取硫化氢气体.以上两种气体可使用如图B所示发生装置的是

(1)制取二氧化碳:
①反应物应选择
石灰石
石灰石
和稀盐酸
稀盐酸
(均填物质名称),反应原理的符号表达式写为CaCO3+2HCl═CaCl2+H2O+CO2↑
CaCO3+2HCl═CaCl2+H2O+CO2↑
.②发生装置选择:
B
B
(填序号),理由反应物是固体和液体不需要加热,长颈漏斗可以随时添加液体药品
反应物是固体和液体不需要加热,长颈漏斗可以随时添加液体药品
.检查这套装置气密性的方法是(写明简单操作、现象及结论)从长颈漏斗口加入水,当液面没过长颈漏斗末端,再将导管一端浸入水中,用两手掌紧握锥形瓶外壁,如果导管口有气泡冒出,说明气密性良好
从长颈漏斗口加入水,当液面没过长颈漏斗末端,再将导管一端浸入水中,用两手掌紧握锥形瓶外壁,如果导管口有气泡冒出,说明气密性良好
.③经检查装置气密性良好后,装入药品开始实验.二氧化碳可用
向上排空气
向上排空气
法或排水法收集,能用排水法收集二氧化碳的原因是产生二氧化碳的速度远大于二氧化碳溶解或与水反应的速度
产生二氧化碳的速度远大于二氧化碳溶解或与水反应的速度
.排水法收集二氧化碳的最佳时机是有气泡连续均匀冒出
有气泡连续均匀冒出
.实验中发现有的组反应器内有大量气泡产生,却长时间收集不到二氧化碳气体,可能的原因有装入固体药品后未旋紧橡皮塞,装置漏气
装入固体药品后未旋紧橡皮塞,装置漏气
.还可用如图D所示装置以排空法收集二氧化碳,使用时,二氧化碳从a
a
管通入.(2)如图C所示,在甲、乙两支试管中分别装有相同质量相同浓度的澄清石灰水,用针管不断向甲试管石灰水中注入空气,通过导管向乙试管石灰水中不断吹气.实验发现,乙试管内的澄清石灰水先变浑浊.该实验能否说明人呼出的气体中二氧化碳浓度大于空气中的二氧化碳浓度?为什么
不能,未控制单位时间内注入气体的量相同
不能,未控制单位时间内注入气体的量相同
.二氧化碳使澄清石灰水变浑浊的反应符号表达式写为Ca(OH)2+CO2═CaCO3↓+H2O
Ca(OH)2+CO2═CaCO3↓+H2O
.(3)实验室用无水醋酸钠和碱石灰两种固体混合共热制取甲烷气体,用硫化亚铁固体与稀硫酸制取硫化氢气体.以上两种气体可使用如图B所示发生装置的是
硫化氢
硫化氢
.分析:(1)①根据实验室制取二氧化碳的物质和方程式的书写方法回答本题;②根据发生装置的选择依据和装置气密性的检查方法考虑;③根据二氧化碳的密度和产生二氧化碳的速度远大于二氧化碳溶解或与水反应的速度考虑收集方法;根据装置漏气不能收集到气体,根据二氧化碳密度比空气大,应该从a端进入,使空气从上端排出;(2)根据对照实验需要控制变量和方程式的书写方法回答本题;(3)根据反应物状态和反应条件选择发生装置.
解答:解:(1)①实验室制取二氧化碳的原料是石灰石(或大理石)和稀盐酸,反应物是碳酸钙和盐酸,生成物是氯化钙、水、二氧化碳,用观察法配平,二氧化碳后面标上上升符号,所以方程式是:CaCO3+2HCl═CaCl2+H2O+CO2↑;
②反应物碳酸钙属于固体,盐酸属于液体不需要加热,且使用长颈漏斗可以随时加入盐酸,所以用B做发生装置,检查装置气密性时,只要能形成密闭容器即可:从长颈漏斗口加入水,当液面没过长颈漏斗末端,再将导管一端浸入水中,用两手掌紧握锥形瓶外壁,如果导管口有气泡冒出,说明气密性良好;
③由于二氧化碳密度比空气大,所以可以用向上排空气法收集,由于产生二氧化碳的速度远大于二氧化碳溶解或与水反应的速度,所以可以用排水法收集二氧化碳;待气泡连续均匀冒出时再进行收集;当装入固体药品后未旋紧橡皮塞,装置漏气,就不会收集到二氧化碳;由于二氧化碳的密度比空气大,所以气体要从a端进入,把空气从b端排出;
(2)在进行对照实验时要控制好变量,才能进行实验对比,该题中未控制单位时间内注入气体的量相同,所以不能得出结论;反应物是氢氧化钙和二氧化碳,生成物是碳酸钙和水,碳酸钙后面标上沉淀符号,所以方程式是:Ca(OH)2+CO2═CaCO3↓+H2O;
(3)图B适合反应物是固体和液体,反应不需要加热,用硫化亚铁固体与稀硫酸制取硫化氢气体,不需要加热.
故答案为:(1)①石灰石;稀盐酸;CaCO3+2HCl═CaCl2+H2O+CO2↑;②B;反应物是固体和液体不需要加热,长颈漏斗可以随时添加液体药品;从长颈漏斗口加入水,当液面没过长颈漏斗末端,再将导管一端浸入水中,用两手掌紧握锥形瓶外壁,如果导管口有气泡冒出,说明气密性良好;③向上排空气;产生二氧化碳的速度远大于二氧化碳溶解或与水反应的速度;有气泡连续均匀冒出;装入固体药品后未旋紧橡皮塞,装置漏气;a;(2)不能,未控制单位时间内注入气体的量相同;Ca(OH)2+CO2═CaCO3↓+H2O;(3)硫化氢.
②反应物碳酸钙属于固体,盐酸属于液体不需要加热,且使用长颈漏斗可以随时加入盐酸,所以用B做发生装置,检查装置气密性时,只要能形成密闭容器即可:从长颈漏斗口加入水,当液面没过长颈漏斗末端,再将导管一端浸入水中,用两手掌紧握锥形瓶外壁,如果导管口有气泡冒出,说明气密性良好;
③由于二氧化碳密度比空气大,所以可以用向上排空气法收集,由于产生二氧化碳的速度远大于二氧化碳溶解或与水反应的速度,所以可以用排水法收集二氧化碳;待气泡连续均匀冒出时再进行收集;当装入固体药品后未旋紧橡皮塞,装置漏气,就不会收集到二氧化碳;由于二氧化碳的密度比空气大,所以气体要从a端进入,把空气从b端排出;
(2)在进行对照实验时要控制好变量,才能进行实验对比,该题中未控制单位时间内注入气体的量相同,所以不能得出结论;反应物是氢氧化钙和二氧化碳,生成物是碳酸钙和水,碳酸钙后面标上沉淀符号,所以方程式是:Ca(OH)2+CO2═CaCO3↓+H2O;
(3)图B适合反应物是固体和液体,反应不需要加热,用硫化亚铁固体与稀硫酸制取硫化氢气体,不需要加热.
故答案为:(1)①石灰石;稀盐酸;CaCO3+2HCl═CaCl2+H2O+CO2↑;②B;反应物是固体和液体不需要加热,长颈漏斗可以随时添加液体药品;从长颈漏斗口加入水,当液面没过长颈漏斗末端,再将导管一端浸入水中,用两手掌紧握锥形瓶外壁,如果导管口有气泡冒出,说明气密性良好;③向上排空气;产生二氧化碳的速度远大于二氧化碳溶解或与水反应的速度;有气泡连续均匀冒出;装入固体药品后未旋紧橡皮塞,装置漏气;a;(2)不能,未控制单位时间内注入气体的量相同;Ca(OH)2+CO2═CaCO3↓+H2O;(3)硫化氢.
点评:解答本题关键是要熟悉实验室制取二氧化碳的药品,反应原理,知道方程式的书写方法,发生装置的选取方法,收集装置的选取方法.

练习册系列答案
 快乐小博士巩固与提高系列答案
快乐小博士巩固与提高系列答案
相关题目
同学们在实验室进行“粗盐中难溶性杂质的去除”实验。以下是小丽同学的实验报告部分内容。
【实验目的】粗盐中难溶性杂质的去除
【实验过程】
① 用托盘天平称取5.0g粗盐,并全部加入到盛有10mL水的烧杯里,边加边用玻璃棒搅拌;
② 过滤食盐水,观察滤液无色透明;
③ 将所得澄清滤液倒入蒸发皿,加热,并用玻璃棒不断搅拌,当液体蒸干时,停止加热;
④ 用玻璃棒把固体转移到纸上,称量,计算所得精盐的产率。
【实验分析】
(1)步骤①中因为 ,导致实验后精盐产率比其他同学偏低。
(2)步骤③中出现的错误操作是
该操作中玻璃棒的作用
A.加快蒸发速率 B.防止因局部温度过高,造成液滴飞溅 C.引流
【实验反思】经过这样操作所得到的精盐是纯净物吗?
【查阅教材】粗盐中含有多种可溶性杂质(氯化镁、氯化钙等)和不溶性杂质(泥沙等)。
【实验设计】
| 实验操作 | 预计实验现象 | 实验结论及解释 |
| ① 将少量所得精盐溶于水,滴加少量稀NaOH溶液 | | 所得精盐中可能含有氯化镁 化学方程式 |
| ② 取实验①中的上层清液继续滴加NaOH溶液至不再有沉淀时,在上层清液中再滴加 溶液 | 出现白色沉淀 | 所得精盐中可能含有氯化钙 化学方程式 |
 2009年3月22日是“世界水日”.水与人类的生活和生产密切相关.
2009年3月22日是“世界水日”.水与人类的生活和生产密切相关.