题目内容
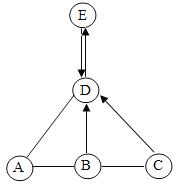
【题目】已知A、B、C、D、E是初中化学常见的物质,其中A、B是黑色固体,D为无色无味气体,E为一种可溶性的盐,B、C、D都是由两种元素组成,且C中不含B、D中的元素,它们之间的转化关系如图所示(“-”表示相连的两种物质之间可以发生反应,“→”表示种物质可以转化成另一种物质,反应条件、部分反应物和生成物已略去)。
回答下列问题:
(1)C的化学式为________________。
(2)A和B反应的基本反应类型是_____________。
(3)写出由D→E反应的化学方程式_______________。
【答案】HCl 置换反应 CO2+2NaOH=Na2CO3+H2O
【解析】
A、B、C、D、E是初中化学常见的物质,其中A、B是黑色固体,故B可能是氧化铜,A能与B相互反应,故A是碳;D为无色无味气体,能由氧化铜转化生成,故D可能是二氧化碳;根据E为一种可溶性的盐,B、C、D都是由两种元素组成,且C中不含B、D中的元素,而C能与氧化铜反应,且能生成二氧化碳,还不含有B、D中的元素,故C可能是盐酸,E可能是碳酸钠,代入框图,推断合理。
(1)根据分析,C是盐酸,故填:HCl;
(2)根据分析,A是碳,B是氧化铜,碳和氧化铜高温反应生成铜和二氧化碳,故反应的化学方程式为:C+2CuO![]() 2Cu+CO2↑,该反应是由一种单质与一种化合物反应生成另一种单质与另一种化合物,属于置换反应。
2Cu+CO2↑,该反应是由一种单质与一种化合物反应生成另一种单质与另一种化合物,属于置换反应。
(3)由D→E反应,即二氧化碳与氢氧化钠溶液反应生成碳酸钠和水,故反应的化学方程式:CO2+2NaOH═Na2CO3+H2O。

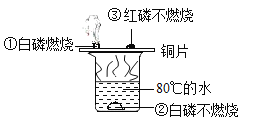
【题目】央视《是真的吗?》栏目中有一段视频:将“锡纸”剪成一段两头宽中间窄的纸条,然后两头分别连接电池的正负极,观察到“锡纸”立即燃烧。据此,某实验小组同学取某种“锡纸”进行了以下探究。
(1)“锡纸”燃烧的原因:“锡纸”两端接入电池两极后造成短路致使“锡纸”燃烧,从燃烧的条件分析:开始“锡纸”不燃烧,但短路后却能燃烧的原因是 。
(2)探究“锡纸”中金属的成分:“锡纸”中的金属是锡吗?
【查阅资料】①“锡纸”是锡箔或铝箔和纸粘合而成;②锌粉是一种深灰色固体;
③ 锡(Sn)与酸或盐溶液反应生成+2价的锡盐。
【提出猜想】猜想Ⅰ:“锡纸”中的金属是锡; 猜想Ⅱ:“锡纸”中的金属是铝。
【进行实验】设计方案并进行实验。
实验操作 | 实验现象 | 实验分析与结论 |
取打磨后的“锡纸”片放入试管中,滴加氯化锌溶液 | “锡纸”表面有深灰色固体析出 | 根据实验现象,结合金属活动性顺序可知猜想 (填“Ⅰ”或“Ⅱ”)成立;反应的化学方程式为: 。 |
【交流讨论】①实验中打磨“锡纸”的目的是 ;
②下列物质的溶液不可以替代氯化锌溶液完成上述实验的是 (填序号)。
A.氯化铜 B.硝酸银 C.硫酸钠 D.硫酸亚铁
【反思应用】
电器短路会引起火灾,我们要严加防范。如果电器着火应该采取的灭火方法是: 。
【探究拓展】该小组为了测定镁铜合金中镁的质量分数,取出3g合金样品,将60g稀硫酸分为6等份依次加入样品中,充分反应后过滤、洗涤、干燥、称重,得到的实验数据如下:
稀硫酸用量 | 第1份 | 第2份 | 第3份 | 第4份 | 第5份 | 第6份 |
剩余固体质量 | m | 2.0g | 1.5g | 1.0g | 0.6g | 0.6g |
(3)表格中,m= 。
(4)合金样品中镁的质量= 。
(5)计算所用稀硫酸中H2SO4的质量分数。(要求写出计算过程,下同)
(6)计算当加入第4份硫酸溶液且充分反应后所得溶液中溶质的质量分数。