题目内容
【题目】将盛有等质量、等质量分数且足量的稀盐酸的两只完全相同的烧杯,放在托盘天平的左右两盘,天平平衡。在左盘烧杯中加入10g碳酸钙,若要使天平重新平衡,则右盘烧杯中应加入的物质可能是(已知:2HCl+CuO=CuCl2+H2O)
A.5.5g氧化铜B.10g镁粉和铜粉
C.10g碳酸钾和碳酸钠D.10g碳酸镁和碳酸钠
【答案】D
【解析】
化学反应遵循质量守恒定律,即化学反应前后,物质的总质量不变,据此分析。
设10g碳酸钙与足量稀盐酸反应生成的二氧化碳的质量为x,
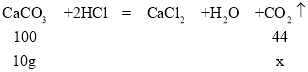
![]()
解得x=4.4g,因此,10g碳酸钙与足量稀盐酸反应生成的二氧化碳的质量为4.4g,该实验中左盘实际增重5.6g;
A、氧化铜与盐酸反应不会生成气体,所以加入5.5克氧化铜则右盘会增重5.5g,所以天平不会平衡,故该选项不符合题意;
B、由于镁与盐酸反应能生成氢气,而铜不能与盐酸反应,假设该金属全部是镁,设生成氢气的质量是y,则
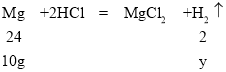
![]()
解得y=0.83g,故不管是镁铜以何种比例混合右盘的增重一定大于5.6g,天平不能平衡;
C、由于碳酸钙的相对分子质量是100,所以要想在加入10g碳酸盐的混合物生成的二氧化碳也是4.4g,必须是两种碳酸盐的相对分子质量一个大于100另一个小于100,而碳酸钾的相对分子质量是138、碳酸钠的相对分子质量是106,都大于100,故该选项错误;
D、由C的分析进行判断,碳酸镁的相对分子质量是84、碳酸钠的相对分子质量是106,所以加入10克碳酸镁和碳酸钠有可能使天平平衡,故该选项正确;
故选D。

练习册系列答案
 唐印文化课时测评系列答案
唐印文化课时测评系列答案 导学与测试系列答案
导学与测试系列答案
相关题目