题目内容
【题目】金属是重要的资源,在日常生活中已得到越来越广泛的应用。
(1)地壳中含量最多的金属元素是_____。
(2)铁制品和铝制品在空气中,________更耐腐蚀。
(3)生活中常用铁锅炒菜,主要是利用了铁的_______。
(4)炼铁原理是利用一氧化碳与氧化铁反应。写出其化学反应方程式_______。
(5)含有镁粉2.4g、铁粉6.6g、铜粉4.2g、铝粉3.6g的混合物与一定质量的稀硫酸充分反应,反应停止后,有8g固体剩余。则生成氢气的质量为_______g。
【答案】铝 铝 导热性 Fe2O3+3CO![]() 2Fe+3CO2 0.7
2Fe+3CO2 0.7
【解析】
(1)地壳中元素含量前五位依次是氧、硅、铝、铁、钙,地壳中含量最多的金属元素是铝元素;故填:铝;
(2)铝比铁活泼,但铝能和空气中的氧气反应生成一层致密而坚硬的氧化物薄膜,从而对铝起到保护作用,铝具有良好的抗腐蚀性;则铝制品在空气中比铁制品更耐腐蚀,故填:铝;
(3)铁具有导热性,所以生活中常用铁锅炒菜;故填:导热性;
(4)工业上用一氧化碳还原氧化铁炼铁,主要是利用CO的还原性,在高温下和氧化铁反应生成铁和二氧化碳,反应的化学方程式为Fe2O3+3CO![]() 2Fe+3CO2;故填:Fe2O3+3CO
2Fe+3CO2;故填:Fe2O3+3CO![]() 2Fe+3CO2;
2Fe+3CO2;
(5)Cu和的金属活动性在(H)之后,不能与稀硫酸发生置换反应,所以剩余的8g固体里肯定有全部的铜;除了铜外还剩3.8g固体应该是铁,因为镁和铝的活动性都比铁强,所以酸先与Mg,Al反应。那么就是2.4gMg、3.6gAl、6.6g-3.8g=2.8g铁和硫酸完全反应了。根据反应的化学方程式和参与反应的镁、铁、铝的质量,就可计算出各自产生氢气的质量。
设镁与硫酸反应生成氢气质量为x,铁与硫酸反应生成氢气质量为y,铝与硫酸反应生成氢气质量为z,
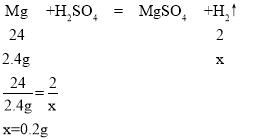
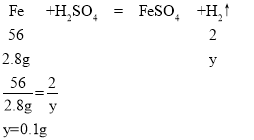
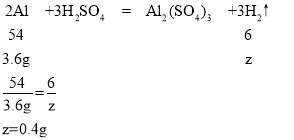
则生成氢气的总质量为:0.2g+0.1g+0.4g=0.7g。
故填:0.7。

【题目】实验室常用加热氯酸钾和二氧化锰固体混合物制取氧气。取30克氯酸钾和二氧化锰的混合物加热,测得剩余固体的质量(m)与反应时间(t)的关系如下表:
反应时间t∕s | t0 | t1 | t2 | t3 | t4 |
反应后固体的质量m∕g | 30 | 27.5 | 24.7 | 20.4 | 20.4 |
请根据相关信息完成下列计算:
(1)完全反应后,生成氧气的质量为____克?
(2)完全反应后,剩余固体中各物质的质量分别为________克?
(3)原固体混合物中氯酸钾的质量分数____?