题目内容
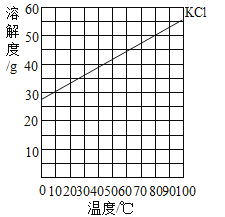
【题目】依据实验和溶解度曲线回答问题。
25℃时,向下列4只盛有100g水的烧杯中,分别加入不同质量的KCl固体,充分溶解。
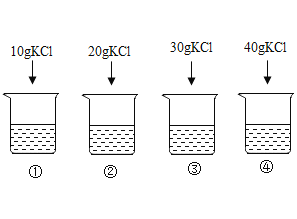
(1)上述烧杯中KCl固体全部溶解的是(______)
A ①② B ②③④ C ③④ D ①②③
(2)④中溶液的溶质质量分数约为(______)
A 40% B 28.6% C 25.9% D 无法计算
(3)如要将120g溶质质量分数为20%的KCl溶液稀释成溶质质量分数为10%的KCl溶液,需要加水的质量为_____g。
【答案】D C 120
【解析】
(1)从溶解度曲线可知:25℃时KCl固体的溶解度为35g,即25℃时100g水中溶解35gKCl固体就达到饱和,所以25℃时100g水中溶解10g、20g、30gKCl固体全部溶解,形成KCl的不饱和溶液。而40gKCl固体不能全部溶解在100g水中,只溶解35gKCl固体。故选D;
(2)从(1)中可以得出:④中溶液为KCl的饱和溶液,所以溶液中溶质的质量分数为:![]() 。故选C;
。故选C;
(3)解:设需加水的质量为x,则:120g×20%=(120g+x)×10%,x=120g,需要加水的质量为120g。

练习册系列答案
 提分百分百检测卷系列答案
提分百分百检测卷系列答案 宝贝计划期末冲刺夺100分系列答案
宝贝计划期末冲刺夺100分系列答案 能考试全能100分系列答案
能考试全能100分系列答案
相关题目
【题目】在一个密闭容器中放入X、Y、Z、W四种物质,在一定条件下发生化学反应,一段时间后,测得有关数据如下表。下列关于此反应的认识,正确的是
物 质 | X | Y | Z | W |
反应前的质量(g) | 20 | m | 16 | 14 |
反应后的质量(g) | 4 | 6 | 60 | 50 |
A.m的数值为64
B.若W为水,则X或Y必定为酸或碱
C.参加反应的X与Y的质量比为1︰4
D.若X为化合物,Y为单质,则该反应一定为置换反应