题目内容
某化学兴趣小组在实验室发现了一瓶标签受到腐蚀(如图所示)的溶液,他们对此产生了兴趣.
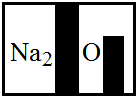
[提出问题]这瓶溶液究竟是什么?
经过询问实验老师平时的药品保管得知,这瓶无色溶液应该是碳酸钠、碳酸氢钠、氯化钠、硫酸钠、硝酸钠中的某一种.为了确定该药品,他们首先进行了理论分析:
(1)小明根据标签上的组成元素认为一定不可能是 .
(2)小英提出,碳酸氢钠、硝酸钠也不可能,你认为她的依据是 .
[设计实验]为了确定该溶液究竟是剩余两种盐的哪一种,他们设计了如下实验.
|
实验操作 |
实验现象 |
|
(1)取少量样品于试管中,慢慢滴加BaCl2溶液 |
出现白色沉淀 |
|
(2)静置一段时间后,倾去上层清液,向沉淀中继续滴加稀盐酸 |
白色沉淀全部溶解,产生大量气泡 |
[实验结论]
(3)该瓶无色溶液是 .生成白色沉淀过程的化学方程式是 .
[实验反思]
(4)小强认为上述设计实验还可简化,仍能达到目的.小强的实验操作是 .
(5)经查阅资料得知上述五种盐里碳酸钠、碳酸氢钠的溶液呈碱性,其余三种盐的溶液呈中性,请你再设计一种实验方法,确定该溶液究竟是哪种盐.简述实验操作和现象.
(6)[综合计算]现取含有氯化钠杂质的纯碱样品25g放入烧杯中,向其中加入50g稀盐酸,二者恰好完全反应.反应结束后称量烧杯中剩余物质的总质量为66.2g(不包括烧杯的质量,且气体的溶解忽略不计).试计算纯碱样品中杂质氯化钠的质量分数.
(1)NaCl;(2)这二者的化学式中Na元素的右下角不会有2;
(3)Na2CO3;BaCl2+Na2CO3═BaCO3↓+2NaCl;(4)取少量无色溶液样品于试管中,慢慢滴加稀盐酸;(5)在玻璃片上放一小片pH 试纸,将样品液滴到试纸上,把试纸显示的颜色与标准比色卡比较,测得溶液pH 大于7.(或取少量无色溶液样品于试管中,滴加几滴无色酚酞,观察到溶液变红等;(6)15.2%.
【解析】
试题分析:(1)氯化钠中不含有氧元素,故不可能是氯化钠;(2)根据碳酸氢钠(NaHCO3)、硝酸钠(NaNO3)的化学式可以知道中钠元素的右下角没有数字2,故不可能是碳酸氢钠和硝酸钠;(3)根据实验的现象,加入氯化钡产生了沉淀,产生的沉淀能与盐酸反应产生气体且全部溶解,故该物质是碳酸钠,氯化钡能与碳酸钠反应生成碳酸钡沉淀和氯化钠,其反应的化学方程式为:BaCl2+Na2CO3═BaCO3↓+2NaCl;(4)碳酸钠能与盐酸反应产生气体,而硫酸钠不与盐酸反应,故可以使用盐酸与样品混合,观察有无气体产生来确定物质的成分;碳酸钠的水溶液呈碱性,而硫酸钠的水溶液呈中性,可以使用测定溶液pH的方法或加入指示剂酚酞的方法来确定物质的成分,可设计实验如下:在玻璃片上放一小片pH试纸,将样品液滴到试纸上,把试纸显示的颜色与标准比色卡比较,测得溶液pH大于7.(或取少量无色溶液样品于试管中,滴加几滴无色酚酞,观察到溶液变红等.
(6)根据质量守恒定律可以知道生成CO2的质量为:25g+50g﹣66.2g═8.8g;
设纯碱样品Na2CO3的质量为x
Na2CO3+2HCl=2NaCl+CO2↑+H2O
106 44
x 8.8g
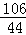 =
=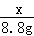
解得:x═21.2g
纯碱样品中杂质氯化钠的质量分数为: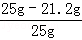 ×100%=15.2%
×100%=15.2%
答:纯碱样品中杂质氯化钠的质量分数为15.2%.
考点:缺失标签的药品成分的探究.

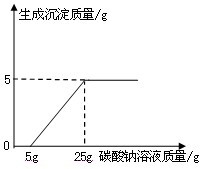 某化学兴趣小组在用石灰石(杂质不与酸反应,也不溶于水)或稀盐酸反应制取二氧化碳,在准备将反应后的废液倒进废液缸时,发现实验桌上有一瓶未知质量分数的Na2CO3溶液,他们决定利用该废液测定这瓶Na2CO3溶液的溶质质量分数.他们先将废液过滤,然后向废液中慢慢滴加Na2CO3溶液,加入Na2CO3溶液的质量与生成沉淀质量的关系如右图所示.
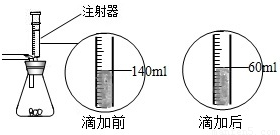
某化学兴趣小组在用石灰石(杂质不与酸反应,也不溶于水)或稀盐酸反应制取二氧化碳,在准备将反应后的废液倒进废液缸时,发现实验桌上有一瓶未知质量分数的Na2CO3溶液,他们决定利用该废液测定这瓶Na2CO3溶液的溶质质量分数.他们先将废液过滤,然后向废液中慢慢滴加Na2CO3溶液,加入Na2CO3溶液的质量与生成沉淀质量的关系如右图所示.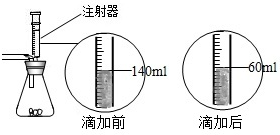 某化学兴趣小组在实验课上制取二氧化碳气体选择了下图的发生装置.在制取完毕后有同学提出该装置还能测得稀盐酸的质量分数.小娜同学称取12.5g含CaCO380%的石灰石粉末样品置于装置中,用注射器滴加稀盐酸至恰好完全反应,滴加前后的数据如如图所示:(杂质与稀盐酸不反应,稀盐酸的密度为1.25g/mL)
某化学兴趣小组在实验课上制取二氧化碳气体选择了下图的发生装置.在制取完毕后有同学提出该装置还能测得稀盐酸的质量分数.小娜同学称取12.5g含CaCO380%的石灰石粉末样品置于装置中,用注射器滴加稀盐酸至恰好完全反应,滴加前后的数据如如图所示:(杂质与稀盐酸不反应,稀盐酸的密度为1.25g/mL)
 某化学兴趣小组在实验课上制取二氧化碳气体选择了下图的发生装置.在制取完毕后有同学提出该装置还能测得稀盐酸的质量分数.小娜同学称取12.5g含CaCO380%的石灰石粉末样品置于装置中,用注射器滴加稀盐酸至恰好完全反应,滴加前后的数据如如图所示:(杂质与稀盐酸不反应,稀盐酸的密度为1.25g/mL)
某化学兴趣小组在实验课上制取二氧化碳气体选择了下图的发生装置.在制取完毕后有同学提出该装置还能测得稀盐酸的质量分数.小娜同学称取12.5g含CaCO380%的石灰石粉末样品置于装置中,用注射器滴加稀盐酸至恰好完全反应,滴加前后的数据如如图所示:(杂质与稀盐酸不反应,稀盐酸的密度为1.25g/mL)