题目内容
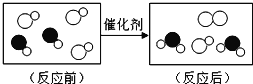
【题目】回收利用是保护金属资源的一条有效途径。某工业废料含氧化铜和氧化铁,经过处理后可得到铜和硫酸亚铁溶液,主要流程如图:(已知:CuO+H2SO4═CuSO4+H2O, Fe2O3+3H2SO4═Fe2(SO4)3+3H2O,Fe+Fe2(SO4)3═3FeSO4)
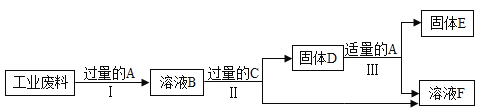
①过程Ⅱ中发生的化学反应基本类型_____(填反应类型名称);
②过程Ⅲ加入适量 A 的作用是_____;
③A~F 中含铁元素的有_____(填序号)。
【答案】化合反应、置换反应 除去剩余的铁,得到纯净的铜 BCDF
【解析】
①溶液 B 中含有硫酸、硫酸铜和硫酸铁,要使硫酸铜转化为铜,可以加入铁, 铁与硫酸反应生成硫酸亚铁和氢气,该反应属于置换反应,铁与硫酸铜反应生成硫酸亚铁和铜,该反应是置换反应;铁与硫酸铁反应生成硫酸亚铁,该反应是化合反应; 故填:化合反应、置换反应;
②为了将硫酸铜中的铜全部置换出来,需要加入过量的铁,要得到纯铜,需要加适量的硫酸将过量的铁除去;故填:除去剩余的铁,得到纯净的铜;
③根据分析推断,A 中含有硫酸,B 中含有硫酸铜和硫酸铁,C 是铁,D 中含有铁和铜,
E 是铜,F 中含有硫酸亚铁,故填:BCDF。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】小军家的下水管道堵了,爸爸买回一种“管道通”,使用后堵塞的管道畅通无阻了。小军对此很好奇,于是想探究“管道通”中的物质成分。
(提出问题)“管道通”中的物质是什么?
(查阅资料)主要内容如下:
(1)下水管道里的淤积物主要为油污、食物残渣、毛发等。
(2)氢氧化钠是强碱,能去除油污,腐蚀毛发一类的东西,常用于疏通管道。
(3)铝粉为银灰色固体,铝粉与酸、碱溶液都能反应放出氢气,反应时放出大量热。
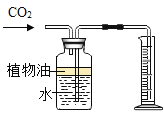
①铝与盐酸反应的化学方程式是____
②铝与氢氧化钠溶液反应的化学方程式是:2A1+2NaOH+2H2O=2NaAlO2+3H2↑。
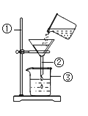
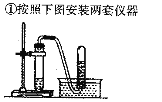
(猜想与验证)小军打开一盒“管道通”,内有袋白色固体颗粒和一袋银灰色粉末。
(1)猜想:白色固体颗粒为氢氧化钠。
实验操作 | 实验现象 |
①将几粒白色固体颗粒放在表面皿上,放置一会儿 | ______ |
②将适量白色固体颗粒放人盛有适量水的试管中,并用手触摸试管外壁 | 试管外壁发烫 |
③向步骤②得到的溶液中放入一段羊毛线,加热一段时间 | 羊毛线逐渐消失 |
结论:白色固体颗粒为氢氧化钠。
(2)猜想:银灰色粉末为铝粉。
实验操作 | 实验现象 |
| |
②一套仪器中加入银灰色粉末和稀盐酸;另一套仪器中加入银灰色粉末和______ | 都产生大量无色气体,试管外壁温度明显升高 |
③待导管口有气泡均匀持续冒出时,分别收集1试管气体,验纯 | 用拇指堵住试管口,移近酒精灯火焰,松开拇指,____ |
④在导管口点燃气体 | 火焰颜色为____ |
(结论)银灰色粉末为铝粉。
(反思)①老师告诉小军,氢氧化钾和氢氧化钠的性质非常相似。要确认猜想(1)是否正确,还需要学习如何检验钠元素的存在;
②根据本实验分析,使用“管道通”时,应注意的事项有____(填一条即可)。