题目内容
【题目】(5分)碳酸钠和碳酸氢钠是生活中常见的两种白色固体。同学们对鉴别这两种物质非常感兴趣,
进行如下探究。
【查阅资料】
1.碳酸钠和碳酸氢钠在不同温度下的溶解度
10℃ | 20℃ | 30℃ | 40℃ | |
Na2CO3 | 12.5 g | 21.5 g | 39.7 g | 49.0 g |
NaHCO3 | 8.1 g | 9.6 g | 11.1 g | 12.7 g |
2.碳酸钠和碳酸氢钠化学性质(部分)的比较
性质 | Na2CO3 | NaHCO3 | 性质比较 |
溶液的酸碱性 | 碱性 | 碱性 | 相同条件下,Na2CO3溶液的碱性更强 |
热稳定性 | 稳定 | 不稳定 | NaHCO3受热分解生成Na2CO3、CO2和H2O |
与盐酸反应 | 反应 | 反应 | 均产生CO2,但NaHCO3与盐酸的反应更加剧烈 |
【设计方案并实施】
实验方案 | 实验现象及结论 |
方案一:___________ | 若有白色固体剩余,样品为碳酸氢钠;否则为碳酸钠。 |
方案二:分别将两种白色固体溶于水制成5%的溶液,___________,将其与标准比色板对照。 | pH值大的为碳酸钠溶液,pH值小的为碳酸氢钠溶液。 |
方案三:分别取少量固体于试管中加 热,然后将产生的气体通入石灰水中。 | ____________ |
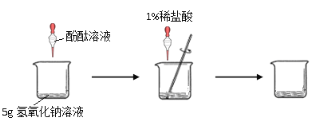
方案四:如下图所示,分别将气球中的固体粉末全部且同时倒入装有过量盐酸的试管中,观察现象。
| ___________________________ |
【实验反思】
通过上述实验,我们知道根据物质的性质设计并进行______实验,能帮助我们更好地理解和掌握相关物质的性质。
【答案】
实验方案 | 实验现象及结论 |
方案一:20 ℃时,在100 g水中加入11 g该白色固体,充分溶解。 | |
方案二:用玻璃棒分别蘸取少量待测液于pH试纸上,静置,观察现象。 | |
若石灰水变浑浊,样品为碳酸氢钠,否则为碳酸钠。 | |
气球胀大速度快且大的,原固体为碳酸氢钠,否则为碳酸钠。 |
【实验反思】对比
【解析】
试题分析:根据资料中表1,碳酸钠和碳酸氢钠在不同温度下的溶解度,在相同的温度下,碳酸氢钠的溶解度比碳酸钠的要小,故可选择表中所提供的四个温度值来设计,方案一:20 ℃时,在100 g水中加入11 g该白色固体,充分溶解,现象及结论:若有白色固体剩余,样品为碳酸氢钠;否则为碳酸钠
根据表2中的信息,相同条件下,Na2CO3溶液的碱性更强,故方案二:用玻璃棒分别蘸取少量待测液于pH试纸上,静置,观察现象,pH值大的为碳酸钠溶液,pH值小的为碳酸氢钠溶液
根据表2中的信息,NaHCO3受热分解生成Na2CO3、CO2和H2O,故方案三:若石灰水变浑浊,样品为碳酸氢钠,否则为碳酸钠
根据表2中的信息,碳酸钠和碳酸氢钠虽然都能与盐酸反应,但NaHCO3与盐酸的反应更加剧烈,且根据化学方程式:Na2CO3+2HCl==2NaCl+H2O+CO2↑中Na2CO3与CO2的质量关系为106:44,而NaHCO3+HCl==NaCl+H2O+CO2↑中NaHCO3与CO2的质量关系为84:44,故相同质量的碳酸钠和碳酸氢钠,碳酸氢钠生成的二氧化碳质量更大,故方案四:如下图所示,分别将气球中的固体粉末全部且同时倒入装有过量盐酸的试管中,观察现象:气球胀大速度快且大的,原固体为碳酸氢钠,否则为碳酸钠
【实验反思】通过上述实验,我们知道根据物质的性质设计并进行对比实验,能帮助我们更好地理解和掌握相关物质的性质

 教材全解字词句篇系列答案
教材全解字词句篇系列答案【题目】(7分)某科研所成功利用染化厂的废料铁泥(主要成分是Fe2O3、FeO和铁)制备可用于隐形飞机涂层的纳米四氧化三铁。
(1)在物质分类中,四氧化三铁属于 (填写物质类别)。在Fe2O3、FeO和Fe3O4三种物质中,铁元素的质量分数最高的是 。
(2)制备过程中要用到双氧水(过氧化氢溶液),其中双氧水的用量、调节的pH、反应时间是三个关键条件,研究时需要进行七组实验。若实验序号1是该制备过程的理论最佳制备条件,请在下表中填入实验序号为5、6、7的三组实验条件(与1-5组实验条件不同)。
实验序号 | 双氧水(mL) | pH | 反应时间(h) |
1 | 0.6 | 10 | 3 |
2 | 0.5 | 10 | 3 |
3 | 0.7 | 10 | 3 |
4 | 0.6 | 11 | 3 |
5 | |||
6 | |||
7 |
(3)调节溶液的pH可用碳酸钠或碳酸氢钠。
查阅资料可:2NaHCO3![]() Na2CO3 +CO2↑+ H2O,此反应的基本类型是 ,此反应证明NaHCO3的热稳定性 Na2CO3(填“大于”或“小于”)。
Na2CO3 +CO2↑+ H2O,此反应的基本类型是 ,此反应证明NaHCO3的热稳定性 Na2CO3(填“大于”或“小于”)。
[注意:若答对以下问题可奖励4分,化学试卷总分不超过60分。]
请你根据以上性质设计实验方案鉴别Na2CO3 和 NaHCO3固体。 。
试写出实验方案中另一个化学反应方程式 。