题目内容
【题目】高纯氧化钙是用于电子工业的重要无机化工原料,用生石灰(主要成分为CaO)制备高纯氧化钙的工艺流程如下:
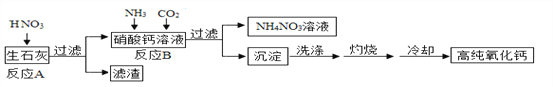
请回答下列问题:
(1)过滤操作中玻璃棒的作用是_______________;
(2)反应B的化学方程式为________________________;
(3)灼烧时发生反应的化学方程式为_________,该工艺流程中可循环使用的物质是_________;
(4)冷却需在密闭和干燥的环境中进行,否则制得的高纯氧化钙中会混有的两种杂质名称分别是___________和__________。
【答案】 引流 Ca(NO3)2+2NH3+CO2+H2O==CaCO3↓+2NH4Cl CaCO3 ![]() CaO+CO2↑ CO2 氢氧化钙 碳酸钙
CaO+CO2↑ CO2 氢氧化钙 碳酸钙
【解析】(1)过滤操作中玻璃棒的作用是引流;
(2)反应B中发生反应的化学方程式为:CO2+2NH3H2O+Ca(NO3)2═2NH4NO3+CaCO3↓+H2O;
(3)反应物是碳酸钙,生成物是氧化钙和二氧化碳,反应条件是高温,二氧化碳后面标上上升符号,所以化学方程式是:CaCO3 ![]() CaO+CO2↑;因为碳酸钙受热分解能生成二氧化碳,二氧化碳在前边的反应中是反应物,所以该工艺流程中可循环使用的物质是二氧化碳;
CaO+CO2↑;因为碳酸钙受热分解能生成二氧化碳,二氧化碳在前边的反应中是反应物,所以该工艺流程中可循环使用的物质是二氧化碳;
(5)冷却需在密闭和干燥的环境中进行,否则制得的高纯氧化钙能和水反应生成氢氧化钙,氢氧化钙和二氧化碳反应生成碳酸钙和水。

 浙江之星课时优化作业系列答案
浙江之星课时优化作业系列答案 激活思维优加课堂系列答案
激活思维优加课堂系列答案【题目】某兴趣小组为探究CaCl2和HCl的混合溶液中CaCl2的质量分数,分别取40g混合溶液,依次加入一定量的Na2CO3溶液,观察到实验中既有气体又有沉淀生成,其中生成沉淀的化学方程式为:Na2CO3+CaCl2![]() CaCO3↓+2NaCl;充分反应后,过滤、洗涤、干燥并称量,加入的Na2CO3溶液质量与所得沉淀质量关系如下表:
CaCO3↓+2NaCl;充分反应后,过滤、洗涤、干燥并称量,加入的Na2CO3溶液质量与所得沉淀质量关系如下表:
实验序号 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ |
Na2CO3溶液质量/g | 10 | 20 | 30 | 40 | 50 | 60 | 70 |
沉淀质量/g | m | 0 | 1 | 2 | 3 | 4 | 4 |
(1)上表中m的值为_______;
(2)计算原混合溶液中CaCl2的质量分数________;
(3)第⑦次实验后所得溶液中的溶质是________________________。