题目内容
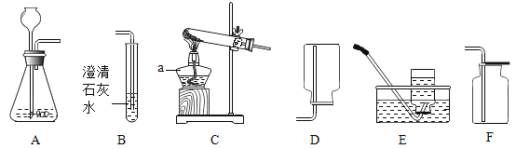
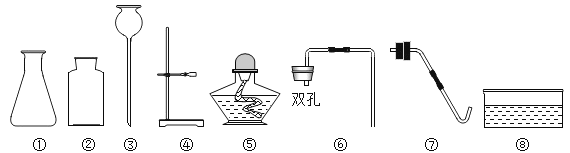
【题目】如图为实验室制取气体的常见装置:
(1)制取和收集气体:任意写出一个实验室制氧气的化学方程式_____.利用该装置制氧气的发生装置为_____(选填“A ””B”)收集装置为_____(“C”“D”“E”),实验室制取二氧化碳的方程式为_____.
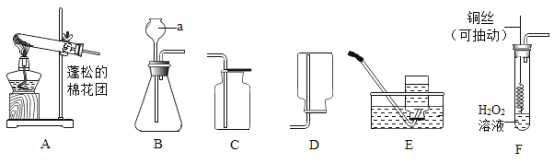
(2)实验改进:查阅资料发现,氧化铜可以做过氧化氢制氧气的催化剂,现有一根洁净的铜丝,实验前先绕成螺旋状,再经_____处理,改进后装置如图F所示,铜丝绕成螺旋状的目的是_____,将铜丝换成铜制的网兜,与改进前装置相比,改进后共同的优点是_____.
(3)温度、浓度、固体的颗粒大小等因素会影响反应速率.为研究实验室制取二氧化碳的适宜条件,进行如表四组实验:
实验编号药品 | 甲 | 乙 | 丙 | 丁 |
mg大理石 | 块状 | 块状 | 粉末状 | 粉末状 |
mg验算(过量) | 稀盐酸 | 浓盐酸 | 稀盐酸 | 浓盐酸 |
①实验甲与_____对照(填编号),是为了研究固体反应物颗粒大小对反应速率的影响;
②上述实验中,另一个影响反应速率的因素是_____.
【答案】2KMnO4![]() K2MnO4+MnO2+O2↑ A C或E CaCO3+2HCl=CaCl2+H2O+CO2↑ 灼烧或加热 增大与过氧化氢溶液的面积,加快反应速率 可以控制反应速率 丙 盐酸的浓度(反应物的浓度)
K2MnO4+MnO2+O2↑ A C或E CaCO3+2HCl=CaCl2+H2O+CO2↑ 灼烧或加热 增大与过氧化氢溶液的面积,加快反应速率 可以控制反应速率 丙 盐酸的浓度(反应物的浓度)
【解析】
(1)高锰酸钾制氧气反应原理:2KMnO4![]() K2MnO4+MnO2+O2↑;选择固体加热装置A,氧气密度比空气大,可以用向上排空气法收集氧气,选装置C;或者氧气不易溶于水,可以选择排水法收集氧气,选择装置E;实验室用大理石和稀盐酸制取二氧化碳气体的反应原理:CaCO3+2HCl=CaCl2+H2O+CO2↑;
K2MnO4+MnO2+O2↑;选择固体加热装置A,氧气密度比空气大,可以用向上排空气法收集氧气,选装置C;或者氧气不易溶于水,可以选择排水法收集氧气,选择装置E;实验室用大理石和稀盐酸制取二氧化碳气体的反应原理:CaCO3+2HCl=CaCl2+H2O+CO2↑;
(2)氧化铜可以做过氧化氢制氧气的催化剂,现有一根洁净的铜丝,实验前先绕成螺旋状,再经灼热或加热处理,是铜变为氧化铜;改进后装置如图F所示,铜丝绕成螺旋状的目的:增大与过氧化氢溶液的面积,加快反应速率;将铜丝换成铜制的网兜,与改进前装置相比,改进后共同的优点:可以控制反应速率;
(3)由图表信息可知,利用控制变量法,①实验甲与丙对照,都使用稀盐酸,是为了研究固体反应物颗粒大小对反应速率的影响;
②上述实验中,另一个影响反应速率的因素是:稀盐酸的浓度(或反应物的浓度)。

 芝麻开花课程新体验系列答案
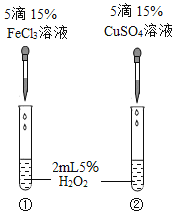
芝麻开花课程新体验系列答案【题目】小玲同学在探究二氧化锰在过氧化氢分解中作催化剂中,设计了以下探究实验。请根据题意答题
(1)实验报告
实验步骤 | 用带火星的木条检验时的现象 |
I.向试管①中倒入5mL30%的过氧化氢溶液 | 不复燃 |
Ⅱ.给试管①稍微加热,如图甲 | 不复燃 |
Ⅲ.向试管②中加入5mL30%的过氧化氢溶液和少量二氧化锰 | 产生大量气泡,带火星的木条复燃 |
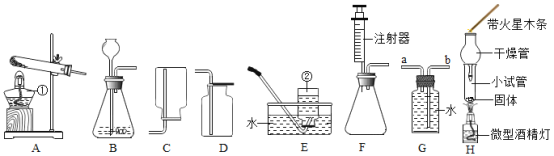
(2)小玲在步骤Ⅱ的装置中,加装了一个U形管(如图乙装置)后,带火星的木条较易复燃。利用图甲装置做实验时,带火星的木条难复燃的原因是______________ ;改用乙装置后带火星的木条能够复燃,装置中冰水的作用是__________
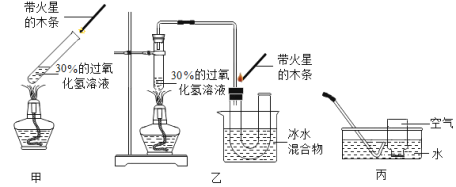
(3)小玲由此还想到了一个问题:能使带火星的木条复燃的气体一定是纯氧气吗?
小玲设计的实验如下:如丙图所示,按下表所示比例,用排水法收集部分氧气,分别得到五瓶空气和氧气的混合气体,进行木条复燃的实验。请你帮他将下表实验现象填写完全。
实验编号 | 空气体积分数% | 排水积分数% | 带火星的木条复燃情况 |
1 | 85 | 15 | 火星稍变亮,不复燃 |
2 | 80 | 20 | 火星明亮,时燃时不燃 |
3 | 75 | 25 | 复燃 |
4 | 70 | 30 | 复燃 |
5 | 50 | 50 | 复燃 |
通过以上实验,可以得出结论是__________小玲还能够粗略得出:使带火星的木条复燃的气体中氧气体积分数的范围是____________。
(4)小玲通过步骤Ⅲ得出二氧化锰能加快过氧化氢分解的结论,但小玮同学提出质疑:过氧化氢溶液由水和过氧化氢组成,也可能是二氧化锰加快水的分解产生氧气。请你设计一个实验证明小玮的猜想_____(请写出操作步骤和实验现象)