题目内容
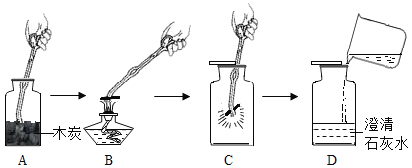
【题目】我国古代将炉甘石(ZnCO3)、赤铜矿(Cu2O)和木炭粉混合加热到约800℃,得到黄铜(铜锌合金,外观似黄金),其流程如下:
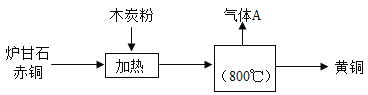
请回答下列问题:
(1)赤铜矿中铜元素的化合价为_____________;
(2)区分黄铜与黄金,可用酒精灯灼烧,若看到_____________,则是黄铜;若表面无现象,则是黄金;
(3)气体A中除CO2外,还有一种气体是_____________(填化学式);
(4)加热时,发生反应的化学方程式有:①ZnCO3![]() ZnO + CO2↑ ②C + 2ZnO
ZnO + CO2↑ ②C + 2ZnO![]() 2Zn + CO2↑ ③________________________;(木炭粉与赤铜的反应)。已知化学反应中,物质所含元素化合价升高的反应叫氧化反应,物质所含元素化合价降低的反应叫做还原反应。在反应②中,ZnO发生___________(填“氧化”或“还原”)反应;
2Zn + CO2↑ ③________________________;(木炭粉与赤铜的反应)。已知化学反应中,物质所含元素化合价升高的反应叫氧化反应,物质所含元素化合价降低的反应叫做还原反应。在反应②中,ZnO发生___________(填“氧化”或“还原”)反应;
【答案】+1 表面变黑 CO 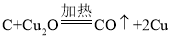 还原
还原
【解析】
(1)由题干文字可知,赤铜矿的主要成分Cu2O,其中氧元素的化合价为:-2价,根据化合物中,正负化合价为零的原则,假设铜元素的化合价为x得,2x+(-2)=0,则x=+1,故填写:+1;
(2)黄铜是铜的合金,而黄金是纯净的金属单质,区别黄铜和黄金,可用灼烧法,由于黄铜中有铜,灼烧后会生成黑色的氧化铜,而黄金不会,故此空填写:表面变黑;
(3)由图可知,炉甘石(ZnCO3)、赤铜矿(Cu2O)和木炭粉(C)混合加热到约800℃时,才产生气体A和黄铜,根据质量守恒定律的实质之一:化学反应前后,元素种类不变,以及氧气的氧化性可知,气体A是CO2和CO的混合气体,故填写:CO;
(4) 木炭粉与赤铜的反应生成铜和一氧化碳,化学方程式为: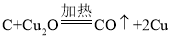 ;
;
由化学方程式②可知,Zn元素的化合价由+2变为了0,而O元素化合价没变,故ZnO发生还原反应,故填写:还原。