题目内容
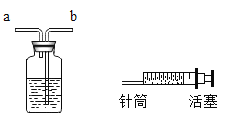
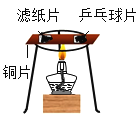
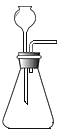
【题目】(1)如图A是某趣味实验装置图,挤压胶头滴管后,可观察到气球胀大的现象,化学方程式是____________________。
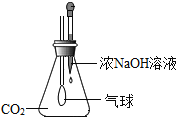
要探究锥形瓶中溶液是否含有NaOH实验的步骤如下:
①向溶液中加入足量的________________;
②再向溶液中加入________________,若溶液变成红色,说明含有NaOH。
(2)盐酸与氢氧化钠溶液反应时溶液pH的变化如图所示。
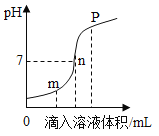
①下列说法正确的是________。
a m点所示溶液为碱性
b n点所示溶液中加紫色石蕊溶液显红色
c p点所示溶液中溶质为NaCl和NaOH
d 该图所对应操作是将盐酸滴入氢氧化钠溶液中
②m点的溶液蒸干后,得到的物质有________。
③判断氢氧化钠和盐酸发生复分解反应,满足的条件是有________生成。
(3)浓硫酸和浓盐酸敞口放置均会变稀,这是为什么?____________________________________。
(4)将73g质量分数为10%的盐酸与100g氢氧化钠恰好完全中和,试计算氢氧化钠溶质中溶质的质量分数________________________。
【答案】![]()
![]() 酚酞 c NaCl 水 浓盐酸具有挥发性,浓硫酸具有吸水性
酚酞 c NaCl 水 浓盐酸具有挥发性,浓硫酸具有吸水性 ![]()
【解析】
(1)氢氧化钠与二氧化碳反应生成碳酸钠和水,故反应的化学方程式写为:2NaOH+CO2=Na2CO3+H2O;
①氢氧化钠与二氧化碳反应生成碳酸钠,碳酸钠与氢氧化钠溶液均显碱性,检验氢氧化钠是否仍存在,需要除去碳酸钠,除去碳酸钠可向溶液中加入足量的氯化钙或氯化钡溶液,故填CaCl2或BaCl2;
②反应后的溶液中不再有碳酸钠,可向溶液中加入酚酞试液,如果溶液变红,说明含有NaOH,故填酚酞。
(2)①a 由图可知,m点所示溶液的pH<7,溶液呈酸碱性,选项错误;
b 由图可知,n点所示溶液的pH=7,溶液显中性,加入紫色石蕊试液后溶液显紫色,选项错误;
c p点所示溶液的pH>7,所以溶液中中溶质为反应生成的NaCl和剩余的NaOH,选项正确;
d 该图所对应操作中溶液的碱性逐渐增强,且最终溶液呈碱性,所以是将氢氧化钠溶液滴入盐酸中,选项错误,故填c;
②由图可知,m点所示溶液的pH<7,则溶液中的溶质是剩余的盐酸与反应生成的氯化钠,溶液蒸干后,水与氯化氢蒸发掉,得到的物质是氯化钠,故填NaCl。
③氢氧化钠与盐酸交换离子后反应生成氯化钠和水,所以该反应为复分解反应的条件是有水生成,故填水。
(3)浓硫酸具有吸水性,能够吸收空气中的水分使溶液中的溶剂增加,从而使溶液变稀,浓盐酸具有挥发性,挥发出溶质氯化氢气体,使溶质的质量减少,进而使溶液变稀,故填浓盐酸具有挥发性,浓硫酸具有吸水性。
(4)解:参加反应的HCl的质量为73g×10%=7.3g
设参加反应的氢氧化钠的质量为x
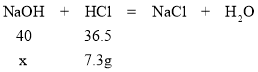
40:36.5=x:7.3g
x=8g
氧化钠溶液中溶质的质量分数为![]() ×100%=8%
×100%=8%
答:氧化钠溶液中溶质的质量分数为8%。