题目内容
【题目】铁、铝、铜是常见的三种金属。同学们发现生活中的铝和铜制品表面一般不用防锈,而铁制品一般需要做防锈处理。
(提出问题)这是不是因为铁、铝、铜三种金属中铁的活动性最强呢?
(实验探究)同学们对这三种金属的活动性顺序展开了探究,请你参与探究并填写空格。
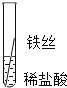
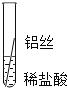
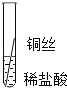
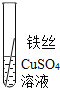
将粗细相同的铁丝、铝丝、铜丝分别插入体积相同、溶质质量分数也相同的稀盐酸中
操作 |
|
|
| 根据现象得出金属活动性顺序 |
片刻后的现象 | 有少量气泡 | 无气泡 | 无气泡 | Fe>Al,Fe>Cu |
几分钟后的现象 | 有少量气泡 | 有大量气泡 | 无气泡 | __________ |
(讨论交流)为什么同一个实验得出了两种结论呢?同学们带着这个疑问查阅了相关资料,明白了铝丝在稀盐酸中短时间内无气泡,是因为铝表面致密的氧化膜会先与盐酸反应。
(反思评价)做金属性质实验时需将金属进行打磨,打磨的目的是 ______
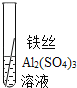
(实验验证)为了进一步确认铁、铝、铜这三种金属的活动性顺序,同学们又将两根粗细相同的、打磨过的铁丝分别插入硫酸铝溶液、硫酸铜溶液中:
操作 |
|
| 根据现象得出金属活动性顺序 |
现象 | 无明显现象 | ______________ | Al>Fe>Cu |
写出铁与硫酸铜溶液反应的化学方程式 _______。
(拓展迁移)(1)实验结束后,老师归纳总结了验证铁、铝、铜这三种金属的活动性顺序的两种方法。晓华提出还有别的方法也可以验证铁、铝、铜这三种金属的活动性顺序。她分别将铝丝和铜丝插入______溶液中(填化学式),观察现象即可知铁、铝、铜,这三种金属的活动性顺序,晓华的想法得到了大家一致赞同。
(2)金属被人类大规模开发利用的大致年限也与金属活动性顺序有关,请写出铁、铝、铜三种金属材料被人类利用的先后顺序 __________。
【答案】Al>Fe>Cu 除去金属表面的氧化物 铁丝表面有红色物质析出,溶液逐渐由蓝色变成浅绿色 Fe+CuSO4=FeSO4+Cu FeSO4溶液 Cu、Fe、Al
【解析】
实验探究:铁丝表面产生少量气泡,铝丝表面产生大量气泡,铜丝表面不产生气泡,说明在相同条件下,铝与稀盐酸反应最剧烈,铁次之,铜不与盐酸反应,所以金属活动性顺序Al>Fe>Cu;
反思评价:实验中可以看出,铝丝表面开始不产生气泡,几分钟后产生大量的气泡,是因为表面有致密的氧化铝薄膜,其它金属也是如此,因此金属性质实验时需将金属进行打磨,以除去金属表面的氧化物;
实验验证:铁的活动性比铜强,铜的颜色为红色,因此铁丝伸入硫酸铜中现象为铁丝表面有红色物质析出,溶液逐渐由蓝色变成浅绿色,铁与硫酸铜反应生成硫酸亚铁和铜,化学方程式为Fe+CuSO4=FeSO4+Cu;
拓展迁移:
(1)分别将铝丝和铜丝插入FeSO4溶液中时,观察到铝丝表面附着黑色固体,说明铝比铁活泼,铜丝表面无明显现象,说明铁比铜活泼,铝比铁活泼,铁比铜活泼;
(2)金属被人类大规模开发利用的大致年限也与金属活动性顺序有关,活动性越强,开发的越晚,因此铁、铝、铜三种金属材料被人类利用的先后顺序为Cu、Fe、Al。

 快乐小博士巩固与提高系列答案
快乐小博士巩固与提高系列答案【题目】某兴趣小组对石灰石样品进行如下实验取12g样品放入烧杯中,将100g稀盐酸分4次加入到烧杯中,充分反应后(杂质不溶于水,也不与酸反应),测得剩余固体的质量记录如下。请计算:
次数 | 1 | 2 | 3 | 4 |
加入稀盐酸的质量/g | 25 | 25 | 25 | 25 |
剩余固体的质量/g | 8 | a | 2 | 2 |
求:
(1)表格中a=_____
(2)样品中碳酸钙的质量为_____g:
(3)第4次加入稀盐酸后所得溶液中CaCl2的质量____?(写出计算过程)。