题目内容
【题目】(1)硝酸氨NH4NO3是一种常见的氮肥,其组成元素(氮、氢、氧)的质量比为_______,其中中氮元素的质量分数为_________
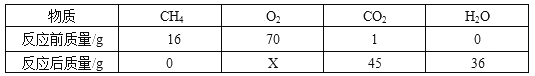
(2)已知6.2克氯酸钾和二氧化锰的混合物,充分加热后剩余固体的质量为4.28克。求:
①生成氧气的质量为______________。
②原混合物中有多少克的氯酸钾_________?
【答案】7:1:12 35% 1.92g 4.9g
【解析】
(1)硝酸铵中氮元素、氢元素、氧元素的质量比=(14×2):(1×4):(16×3)=7:1:12;氮元素的质量分数=![]() ;
;
(2)①根据质量守恒定律,生成氧气的质量=6.2g-4.28g=1.92g;
②设原来固体中氯酸钾的质量为x。
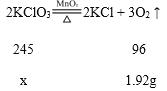
![]() 解得:x=4.9g。
解得:x=4.9g。

【题目】铁、铝、铜是常见的三种金属。同学们发现生活中的铝和铜制品表面一般不用防锈,而铁制品一般需要做防锈处理。
(提出问题)这是不是因为铁、铝、铜三种金属中铁的活动性最强呢?
(实验探究)同学们对这三种金属的活动性顺序展开了探究,请你参与探究并填写空格。
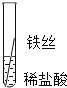
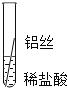
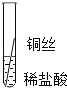
将粗细相同的铁丝、铝丝、铜丝分别插入体积相同、溶质质量分数也相同的稀盐酸中
操作 |
|
|
| 根据现象得出金属活动性顺序 |
片刻后的现象 | 有少量气泡 | 无气泡 | 无气泡 | Fe>Al,Fe>Cu |
几分钟后的现象 | 有少量气泡 | 有大量气泡 | 无气泡 | __________ |
(讨论交流)为什么同一个实验得出了两种结论呢?同学们带着这个疑问查阅了相关资料,明白了铝丝在稀盐酸中短时间内无气泡,是因为铝表面致密的氧化膜会先与盐酸反应。
(反思评价)做金属性质实验时需将金属进行打磨,打磨的目的是 ______
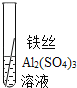
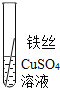
(实验验证)为了进一步确认铁、铝、铜这三种金属的活动性顺序,同学们又将两根粗细相同的、打磨过的铁丝分别插入硫酸铝溶液、硫酸铜溶液中:
操作 |
|
| 根据现象得出金属活动性顺序 |
现象 | 无明显现象 | ______________ | Al>Fe>Cu |
写出铁与硫酸铜溶液反应的化学方程式 _______。
(拓展迁移)(1)实验结束后,老师归纳总结了验证铁、铝、铜这三种金属的活动性顺序的两种方法。晓华提出还有别的方法也可以验证铁、铝、铜这三种金属的活动性顺序。她分别将铝丝和铜丝插入______溶液中(填化学式),观察现象即可知铁、铝、铜,这三种金属的活动性顺序,晓华的想法得到了大家一致赞同。
(2)金属被人类大规模开发利用的大致年限也与金属活动性顺序有关,请写出铁、铝、铜三种金属材料被人类利用的先后顺序 __________。
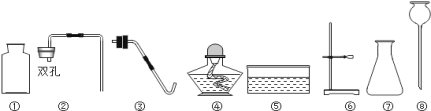
【题目】水煤气是水蒸气通过炽热的焦炭而生成的气体,是一种燃烧快、热效高、燃耗低、污染低的气体燃料。 在实际生产中,可向固定床煤气化炉交替通入空气和水蒸气而制得。为确定某水煤气的成分,南雅中学化学 兴趣小组在田老师的指导下,对此进行了实验探究
(提出猜想)1.该混合气体含有 N2、CO、H2 ;2. 该混合气体含有 N2、CO、CO2 、H2 和 H2O;3. 该混合气体含有 N2、CO2、H2 和 H2O;4. 该混合气体含有 N2、CO、CO2和 H2
(查阅资料)a.无水硫酸铜遇水由白色变为蓝色 b.氢氧化钠溶液可用于吸收 CO2 气体. c.浓硫酸具有强烈的吸水性,常用作某些气体的干燥剂
(实验过程)同学们在老师的指导下设计了如下图所示装置,并进行了实验
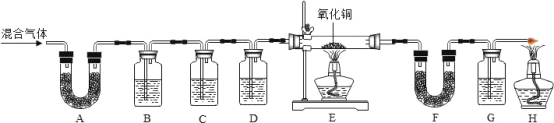
(实验现象、分析、结论)
现象 | 分析 | 结论 | |
装置 A 中无水硫酸铜不变蓝,装置 B 中混气体 中澄清石灰水变浑浊 | 混气体中_____。 | 猜想_____成立 | |
E 中固体变为红色 | F 无水硫酸铜变为蓝 色 | 混合气体中还含有的 气体是_____。 | |
G 中澄清石灰水变浑浊 | E 处一定发生的反应 是:_____。 | ||
(实验反思)A 装置与 B 装置可否调换位置?_____(填“能”或“不能”),原因是_____。