题目内容
(9分)以下是某化学兴趣小组实施的从硝酸钾、氯化钠、氯化钾的混合物(其中氯化钠和氯化钾的质量和小于总质量的3%)中分离出硝酸钾的实验步骤:(三种物质的溶解度曲线见右图)
Ⅰ.用托盘天平称得样品的总质量为87.5g;
Ⅱ.配制成80℃左右的饱和溶液;
Ⅲ.将热饱和溶液冷却至室温(20℃)后进行过滤,并用少量水洗涤2—3次;
Ⅳ.取出过滤器中的固体,干燥后分装。
请回答以下问题:
(1)用天平称取87.5g样品时,砝码应放在天平的 ▲ 盘;
(2)某同学发现,无论将称量物还是砝码放置于托盘中时,天平均不发生偏转,原因是 ▲
A.天平未放置于水平桌面上
B.天平没有调零
C.托盘下的垫圈未取下
D.游码未归零
(3)将这些样品制成80℃左右的热饱和溶液,约需 ▲ 水(填序号);
A.12.5mL B.50 mL C.100mL D.112.5mL
(4)该实验中,玻璃棒除了用于搅拌和引流外,还用于 ▲ ;
(5)步骤Ⅲ中,只能用少量水洗涤固体的原因是 ▲ ;
(6)过滤并洗涤后,氯化钾存在于 ▲ 中;
(7)如果实验中热饱和溶液未完全冷却至室温就进行过滤将会影响晶体的产量,理由是 ▲ 。
(9分)
(1)右(1分) (2)C(2分) (3)B(2分)
(4)转移固体(1分)
(5)因晶体易溶于水,洗涤用水越少,晶体质量损失越小(1分)
(6)滤液(1分)
(7)根据溶解度曲线可知,该硝酸钾饱和溶液在较高温度下结晶,析出的晶体质量较少 (1分)
解析:略

练习册系列答案
 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案
相关题目
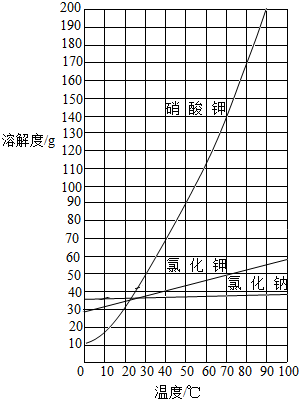 以下是某化学兴趣小组实施的从硝酸钾、氯化钠、氯化钾的混合物(其中氯化钠和氯化钾的质量和小于总质量的3%)中分离出硝酸钾的实验步骤:(三种物质的溶解度曲线见图)
以下是某化学兴趣小组实施的从硝酸钾、氯化钠、氯化钾的混合物(其中氯化钠和氯化钾的质量和小于总质量的3%)中分离出硝酸钾的实验步骤:(三种物质的溶解度曲线见图)
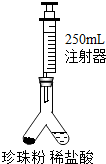 (2013?海安县一模)珍珠粉以其良好的养颜等功效,获得消费者喜爱.资料显示:珍珠中含碳酸钙80-93%、蛋白质4-14%、水份2-4%、十几种氨基酸、28种微量元素.然而一些不法分子用回收的贝壳加上工业用氢氧化钠配制的药水进行清洗、晾晒以后直接加工销售,其主要成分是:碳酸钙,及少量残留氢氧化钠.以下是某化学兴趣小组设计辨别真假珍珠,并测定珍珠中碳酸钙含量的实验探究方案.
(2013?海安县一模)珍珠粉以其良好的养颜等功效,获得消费者喜爱.资料显示:珍珠中含碳酸钙80-93%、蛋白质4-14%、水份2-4%、十几种氨基酸、28种微量元素.然而一些不法分子用回收的贝壳加上工业用氢氧化钠配制的药水进行清洗、晾晒以后直接加工销售,其主要成分是:碳酸钙,及少量残留氢氧化钠.以下是某化学兴趣小组设计辨别真假珍珠,并测定珍珠中碳酸钙含量的实验探究方案.