题目内容
【题目】(一)铝及其化合物是我们日常生活中不可缺少的物质,如航空航天材料—硬铝。
(1)Al和CuSO4溶液反应的化学方程式为____,该反应说明____;
(2)生活中铝比铁更耐腐蚀的原因____(用化学反应方程式解释)。
(二)某学生在学习盐的性质时做了氯化铝溶液和氢氧化钠溶液反应的实验。该学生向氯化铝溶液中逐滴滴加氢氧化钠溶液时,发现溶液中有沉淀生成,且沉淀量先增多后减少直至消失。经查资料知:
Al(OH)3是一种两性氢氧化物,它既可以与酸反应又可以与碱反应都生成盐和水。它与碱反应的化学方程式为:Al(OH)3+NaOH=NaAlO2+2H2O,NaAlO2可溶于水。
(1)该学生将100.0g53.4%的AlCl3溶液和100.0gNaOH溶液混合,充分反应后过滤得到27.3g沉淀,则所加NaOH溶液的质量分数为__。
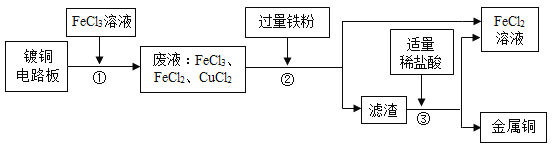
(2)该学生另将ag硬铝(Mg、Al、Cu、Si合金)溶于200.0g盐酸中,充分反应后过滤,向滤液中逐滴滴加20.0%的NaOH溶液至过量,产生的沉淀与NaOH溶液的质量关系如下图:
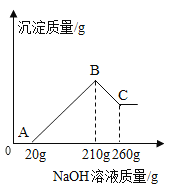
①O→A段的化学反应方程式为____;
②盐酸的质量分数是____。
【答案】2Al+3CuSO4=Al2(SO4)3+3Cu 铝比铜活泼 4Al+3O2=2Al2O3 50% NaOH+HCl=NaCl+H2O 19.2%
【解析】
(一)(1)Al和CuSO4溶液反应的化学方程式为 2Al+3CuSO4=Al2(SO4)3+3Cu,该反应说明 铝比铜活泼;
(2)生活中铝比铁更耐腐蚀的原因是因为铝容易和氧气反应生成致密的氧化膜从而阻止氧气和铝接触,阻止了继续锈蚀,对应的化学方程式为:4Al+3O2=2Al2O3。
(二)某学生在学习盐的性质时做了氯化铝溶液和氢氧化钠溶液反应的实验。该学生向氯化铝溶液中逐滴滴加氢氧化钠溶液时,发现溶液中有沉淀生成,且沉淀量先增多后减少直至消失。经查资料知:
Al(OH)3是一种两性氢氧化物,它既可以与酸反应又可以与碱反应都生成盐和水。它与碱反应的化学方程式为:Al(OH)3+NaOH═NaAlO2+2H2O,NaAlO2可溶于水。
(1)设100.0g53.4%的AlCl3溶液完全驻华为氢氧化铝,所得氢氧化铝的质量为x,消耗的氢氧化钠的质量为y
100.0g53.4%的AlCl3溶液所含氯化铝的质量为100.0g×53.4%=53.4g,
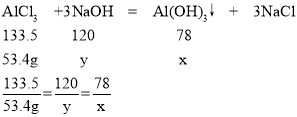
x=31.2g
y=48g
充分反应后过滤得到27.3g沉淀,说明氢氧化铝和氢氧化钠反应掉了31.2g-27.3g=3.9g
设消耗的氢氧化钠的质量为z
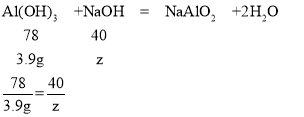
z=2g
所加NaOH溶液的质量分数为 ![]() ×100%=50%。
×100%=50%。
(2)O→A段没有沉淀产生,是剩余的盐酸和氢氧化钠反应生成氯化钠和水,对应的化学反应方程式为NaOH+HCl=NaCl+H2O。
设盐酸的质量分数是a
根据Mg+2HCl=MgCl2+H2↑
2Al+6HCl=2AlCl3+3H2↑
AlCl3+3NaOH═Al(OH)3↓+3NaCl
MgCl2+2NaOH═Mg(OH)2↓+2NaCl
NaOH+HCl=NaCl+H2O
可得关系式为
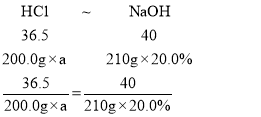
a≈19.2%。
故答案为:
(一)(1)2Al+3CuSO4=Al2(SO4)3+3Cu;铝比铜活泼;
(2)4Al+3O2=2Al2O3。
(二) (1)50%。(2)①NaOH+HCl=NaCl+H2O;②19.2%。

【题目】下列除去杂质的方法中,错误的是( )
选项 | 物质 | 杂质 | 除杂质的方法 |
A. | 铜粉 | 铁粉 | 加入足量稀盐酸、过滤、洗涤、干燥 |
B. | CaCl2溶液 | 稀盐酸 | 过量CaCO3、过滤 |
C. | FeCl2溶液 | CuCl2 | 过量铁粉、过滤 |
D. | 木炭粉 | 铜粉 | 在空气中灼烧 |
A.AB.BC.CD.D
【题目】善于梳理化学知识,能使你更好地掌握知识。对某一主题知识进行归纳完全正确的是( )
A.材料知识 | B.化学与农业 |
①钢筋混凝土和玻璃钢:复合材料 ②黄铜和不锈钢:金属材料 ③涤纶和塑料:有机合成材料 | ①氮肥:使作物枝叶繁茂,叶色浓绿 ②钾肥:增强作物抗病和抗倒伏能力 ③磷肥:增强作物耐寒耐旱能力 |
C.化学符号与其表示意义 | D.安全常识 |
①氧化镁中镁元素的化合价: ② ③一个钙离子: | ①稀释浓硫酸:水倒入浓硫酸中 ②煤气泄露:严禁火种 ③菜窖取菜:须做灯火实验 ④减少酸雨:使用新型能源 |
A. AB. BC. CD. D