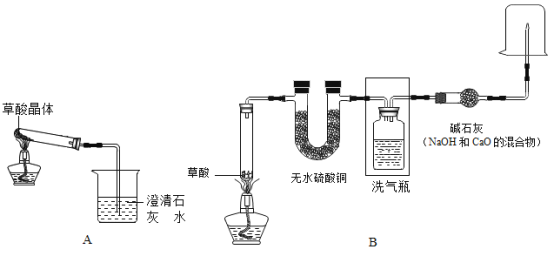
题目内容
【题目】业上生产电路板及处理废液的工艺流程如下:
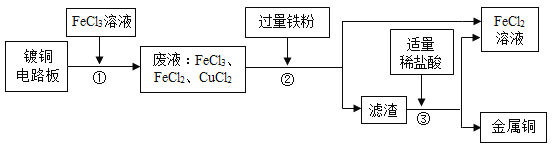
(1)由步骤①可判断FeCl3与铜反应生成的两种产物是________和________。
(2)步骤②加入过量的铁粉,除能与废液中CuCl2反应外,还可发生反应的化学方程式为_______。该反应的基本类型是:_______反应。
(3)步骤③加入稀盐酸,充分搅拌,当观察到_______________现象时,说明滤渣只剩铜。
(4)步骤②③所得FeCl2可与一种单质发生化合反应生成FeCl3,实现循环使用。根据质量守恒定律可推测该单质的化学式为Cl2,已知Cl2与H2O反应的化学方程式为:Cl2+H2O =HCl +HClO,则Cl2与氢氧化钙溶液反应的化学方程式为:__________________。
【答案】FeCl2 CuCl2 Fe+2FeCl3═3FeCl2 化合 不再有气泡产生 2Ca(OH)2+2Cl2═CaCl2+Ca(ClO)2+2H2O
【解析】
(1)向镀铜的电路板中加入氯化铁溶液后生成了氯化铜和氯化亚铁,即为铜和氯化铁溶液反应的产物;
(2)铁能与氯化铁反应生成氯化亚铁,化学方程式为Fe+2FeCl3═3FeCl2;属于化合反应
(3)加入过量的铁粉过滤后的得到滤渣应该为铁粉和铜的混合物,所以加入盐酸后,铁要和盐酸反应产生氢气,而铜不反应,所以至不在产生气泡时得到的固体只有铜单质;
(4)Cl2与氢氧化钙溶液反应生成氯化钙、次氯酸钙和水,化学方程式为2Ca(OH)2+2Cl2═CaCl2+Ca(ClO)2+2H2O。
故答案为:(1)FeCl2;CuCl2;
(2)Fe+2FeCl3═3FeCl2;化合;
(3)不再有气泡产生;
(4)2Ca(OH)2+2Cl2═CaCl2+Ca(ClO)2+2H2O.

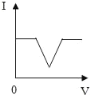
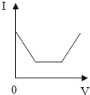
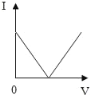
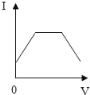
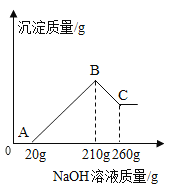
【题目】向盛有20g10%氢氧化钠溶液的烧杯中逐滴滴入7.3%的稀盐酸,下列是关于溶液总质量或溶液pH随盐酸质量变化的关系图(Q点表示恰好完全反应)。其中正确的是

A. A B. B C. C D. D
【题目】小明同学对所学部分化学知识归纳如下,其中正确的是
A | 须辨清的物质 | B | 初中化学中常见的“三” |
干冰不是冰——而是固体CO2 纯碱不是碱——而是盐 水银不是银——而是汞 | 三种可燃性气体——CO、H2、N2 三种有毒物质——CO、亚硝酸钠、H2 三种基本粒子——原子、分子、离子 | ||
C | 化学巨匠及其杰出贡献 | D | 符号中数字“2”的意义 |
张青莲——测量相对原子质量 拉瓦锡——测定空气的组成 侯德榜——发明联合制碱法 | 2O:两个氧分子
O2:两个氧原子 |
A.AB.BC.CD.D