题目内容
【题目】实验设计是化学实验的重要环节。请根据下列实验要求回答相关问题:
【活动与探究一】收集不同体积比例的二氧化碳和一氧化碳混合气体。
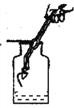
方案一:如图所示:
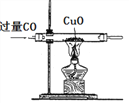
(1)请写出硬质玻璃管中发生反应的化学方程式______________________:
(2)该实验能获得二氧化碳和一氧化碳混合气体,其原因是____________________。
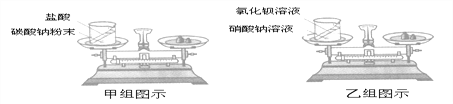
方案二:根据如图装置所示请回答下列问题:
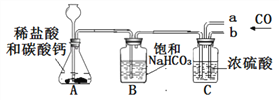
(提示:饱和NaHCO3溶液的作用是除去HCl气体,部分夹持装置及导管已略去)
(1)写出装置A中发生反应的化学方程式:____________________________________。
(2)CO气体应由__________(填“a”或“b”)通入,在C中混合后,由另一导管导出。
(3)装置C中浓硫酸的两点主要作用:①干燥气体,减少实验误差;②____________________。
【活动与探究二】测定某钙片中碳酸钙的质量分数,用如图装置进行如下实验:①取研碎后的钙片4克,倒入气密性良好的锥形瓶中,然后在分液漏斗中加入适量的稀盐酸,置于电子天平上测出装置总质量。②打开活塞,滴入足量稀盐酸后关闭活塞,待气泡不再冒出时,测出反应后装置总质量。③整理相关数据如下表,计算出钙片中碳酸钙的质量分数。
反应前总质量(克) | 275.58 |
反应后总质量(克) | 274.92 |
反应前后质量差(克) | 0.66 |
容器内气体质量差(克) | m |
(1)该实验中,如果装置中不加固态干燥剂(吸水不吸二氧化碳),则最终所算得钙片中碳酸钙的质量将_______________(填“偏大”“偏小”或“不变”)。
(2)反应前容器内是空气(密度为ρ1),反应后全部是CO2(密度为ρ2)。则反应前后容器(容积为V)内的气体质量差m为________。(用字母表示,反应物的体积忽略不计)
(3)小明查阅有关数据后,计算出反应前后容器内的气体质量差m为0.22克,结合表中数据,计算该钙片中碳酸钙的质量分数为_____________。(钙片中的其它成分不与盐酸反应)
【答案】 略 CO过量 略 b 通过两种气体的气泡数量可判断两种气体的体积比 偏大 (ρ2--ρ1 )V 50%
【解析】(1)一氧化碳和氧化铜在加热条件下生成铜和二氧化碳,反应的化学方程式CuO+CO![]() Cu+CO2;(2)该实验能获得二氧化碳和一氧化碳混合气体,其原因是通入装置内的一氧化碳气体有剩余。方案二:(1)碳酸钙和盐酸反应生成氯化钙、二氧化碳、水,反应的化学方程式:CaCO3 + 2HCl == CaCl2 + H2O + CO2↑;(2)CO气体应由b通入,在C中混合后,被浓硫酸干燥后,和二氧化碳混合,由a导管导出的一氧化碳和二氧化碳的混合物;(3)装置C中浓硫酸的两点主要作用:①干燥气体,减少实验误差;②通过两种气体的气泡数量可判断两种气体的体积比;【活动与探究二】(1)该实验中,如果装置中不加固态干燥剂(吸水不吸二氧化碳),则最终所算得钙片中碳酸钙的质量将偏大;(2)二氧化碳的密度比空气大,反应前容器内是空气(密度为ρ1),反应后全部是CO2(密度为ρ2)。则反应前后容器(容积为V)内的气体质量差m为(ρ2--ρ1 )V;(3) 设钙片中碳酸钙的质量为x
Cu+CO2;(2)该实验能获得二氧化碳和一氧化碳混合气体,其原因是通入装置内的一氧化碳气体有剩余。方案二:(1)碳酸钙和盐酸反应生成氯化钙、二氧化碳、水,反应的化学方程式:CaCO3 + 2HCl == CaCl2 + H2O + CO2↑;(2)CO气体应由b通入,在C中混合后,被浓硫酸干燥后,和二氧化碳混合,由a导管导出的一氧化碳和二氧化碳的混合物;(3)装置C中浓硫酸的两点主要作用:①干燥气体,减少实验误差;②通过两种气体的气泡数量可判断两种气体的体积比;【活动与探究二】(1)该实验中,如果装置中不加固态干燥剂(吸水不吸二氧化碳),则最终所算得钙片中碳酸钙的质量将偏大;(2)二氧化碳的密度比空气大,反应前容器内是空气(密度为ρ1),反应后全部是CO2(密度为ρ2)。则反应前后容器(容积为V)内的气体质量差m为(ρ2--ρ1 )V;(3) 设钙片中碳酸钙的质量为x
反应后生成的二氧化碳的质量为:0.66g+0.22g=0.88g
CaCO3+2HCl=CaCl2+H2O+CO2↑
100 44
x 0.88g
100/44=x/0.88g解得:x=2g
该钙片中碳酸钙的质量分数为:2g÷4g×100%=50%
答:(1)能吸收水但不吸收二氧化碳;(2)(ρ2﹣ρ1)V;(3)该钙片中碳酸钙的质量分数为50%。

 53随堂测系列答案
53随堂测系列答案【题目】合成氨是人类科学技术上得一项重大突破,对社会发展与进步做出了巨大贡献。合成氨的工艺流程图如下:

(1)合成氨需要的氮气来自空气,空气中氮气的体积分数约为 。
(2)制取氢气的反应过程为:C+H2O![]() CO+H2,CO+H2O
CO+H2,CO+H2O![]() CO2+H2。上述第一个化学方程式中表现还原性的物质是 (填化学式);在第二个反应中有CO2
CO2+H2。上述第一个化学方程式中表现还原性的物质是 (填化学式);在第二个反应中有CO2
生成,它对环境造成的影响是 。
(3)写出N2、H2反应生成NH3的化学方程式 。
(4)将沸点不同的气体分离开来,常采用液化分离法。如,控制温度在﹣183℃时,可将空气中N2与O2分离。根据下表中物质的沸点判断,要将产物NH3与N2、H2分离开来,温度应该控制在 ℃。
物质 | H2 | N2 | O2 | NH3 |
沸点 | ﹣252℃ | ﹣195.8℃ | ﹣183℃ | ﹣33.35℃ |
【题目】某化工厂用废硫酸制备K2SO4的流程如下:
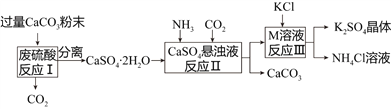
物质 | KCl | K2SO4 | NH4Cl | (NH4)2SO4 |
溶解度/g(20℃) | 34.2 | 11.1 | 37.2 | 75.4 |
(1)生产上将CaCO3研成粉末的目的是________________________________________。
(2)上述流程中,除可综合利用CO2外,还可循环使用的物质是____________________(填写化学式);
(3)写出反应Ⅲ的化学方程式:___________________________________;你认为反应Ⅲ在常温下能实现的原因是__________________________________________________。
(4)洗涤反应Ⅲ所得晶体最好用下列_______(填序号),选择该试剂的原因是___________。
a.BaCl2溶液 b.饱和NH4Cl溶液 c.冷水 d.饱和K2SO4溶液