题目内容
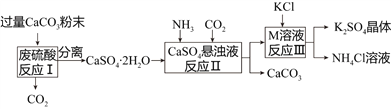
【题目】某化工厂用废硫酸制备K2SO4的流程如下:
物质 | KCl | K2SO4 | NH4Cl | (NH4)2SO4 |
溶解度/g(20℃) | 34.2 | 11.1 | 37.2 | 75.4 |
(1)生产上将CaCO3研成粉末的目的是________________________________________。
(2)上述流程中,除可综合利用CO2外,还可循环使用的物质是____________________(填写化学式);
(3)写出反应Ⅲ的化学方程式:___________________________________;你认为反应Ⅲ在常温下能实现的原因是__________________________________________________。
(4)洗涤反应Ⅲ所得晶体最好用下列_______(填序号),选择该试剂的原因是___________。
a.BaCl2溶液 b.饱和NH4Cl溶液 c.冷水 d.饱和K2SO4溶液
【答案】 增大CaCO3接触面积,加快后续实验化学反应的反应速率 CaCO3 (NH4)2SO4+2KCl===2NH4Cl+K2SO4↓ 略 d 洗涤时可防止K2SO4晶体溶解
【解析】(1)将CaCO3研成粉末,可以增大反应物的接触面积,其目的是加快反应速率;
(2)观察上述流程,发现二氧化碳和碳酸钙既是反应物也是生成物,故可循环使用的物质有CO2和CaCO3;
(3)由于反应Ⅲ加入氯化钾生成氯化铵和硫酸钾,所以M为硫酸铵,反应的化学方程式:(NH4)2SO4+2KCl=2NH4Cl+K2SO4↓;根据复分解反应发生的条件,反应Ⅲ中虽没有不溶物,但常温下K2SO4的溶解度小,在生成物中会以沉淀的形式出现,故反应可以进行;
(4)a、由于BaCl2与K2SO4反应,所以不能用BaCl2溶液洗涤反应Ⅲ所得晶体;
b、常温下K2SO4的溶解度小,但不意味着不溶,K2SO4会溶解在饱和NH4Cl溶液中,所以不能用饱和NH4Cl溶液洗涤反应Ⅲ所得晶体;
c、常温下K2SO4的溶解度小,但不意味着不溶,K2SO4会溶解在冷水中,所以不能用冷水洗涤反应Ⅲ所得晶体;
d、饱和K2SO4溶液洗涤反应Ⅲ所得晶体的目的是防止K2SO4的溶解,所以能用饱和K2SO4溶液洗涤反应Ⅲ所得晶体。

 名师伴你成长课时同步学练测系列答案
名师伴你成长课时同步学练测系列答案【题目】实验设计是化学实验的重要环节。请根据下列实验要求回答相关问题:
【活动与探究一】收集不同体积比例的二氧化碳和一氧化碳混合气体。
方案一:如图所示:

(1)请写出硬质玻璃管中发生反应的化学方程式______________________:
(2)该实验能获得二氧化碳和一氧化碳混合气体,其原因是____________________。
方案二:根据如图装置所示请回答下列问题:

(提示:饱和NaHCO3溶液的作用是除去HCl气体,部分夹持装置及导管已略去)
(1)写出装置A中发生反应的化学方程式:____________________________________。
(2)CO气体应由__________(填“a”或“b”)通入,在C中混合后,由另一导管导出。
(3)装置C中浓硫酸的两点主要作用:①干燥气体,减少实验误差;②____________________。
【活动与探究二】测定某钙片中碳酸钙的质量分数,用如图装置进行如下实验:①取研碎后的钙片4克,倒入气密性良好的锥形瓶中,然后在分液漏斗中加入适量的稀盐酸,置于电子天平上测出装置总质量。②打开活塞,滴入足量稀盐酸后关闭活塞,待气泡不再冒出时,测出反应后装置总质量。③整理相关数据如下表,计算出钙片中碳酸钙的质量分数。
反应前总质量(克) | 275.58 |
反应后总质量(克) | 274.92 |
反应前后质量差(克) | 0.66 |
容器内气体质量差(克) | m |
(1)该实验中,如果装置中不加固态干燥剂(吸水不吸二氧化碳),则最终所算得钙片中碳酸钙的质量将_______________(填“偏大”“偏小”或“不变”)。
(2)反应前容器内是空气(密度为ρ1),反应后全部是CO2(密度为ρ2)。则反应前后容器(容积为V)内的气体质量差m为________。(用字母表示,反应物的体积忽略不计)
(3)小明查阅有关数据后,计算出反应前后容器内的气体质量差m为0.22克,结合表中数据,计算该钙片中碳酸钙的质量分数为_____________。(钙片中的其它成分不与盐酸反应)