题目内容
【题目】铜镁合金常用作飞机天线等导电材料。欲测定某铜镁合金的组成(其他元素忽略不计),进行如下实验:取该铜镁合金10g放入烧杯,将140g稀硫酸分4次加入烧杯中,充分反应后,测得剩余固体的质量记录如下。请回答下列问题:
次数 | 1 | 2 | 3 | 4 |
加人稀硫酸质量/g | 35 | 35 | 35 | 35 |
剩余固体质量/g | 9.1 | 8.2 | a | 6.5 |
(1)该铜镁合金中镁与铜的质量比为____________;第4次加入稀硫酸反应后,溶液中溶质成分是____________。
(2)表中a的数值为____________,计算所加稀硫酸的溶质质量分数为_________。
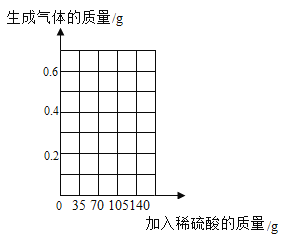
(3)在图中画出加入稀硫酸的质量与生成气体的质量关系的曲线图________。
【答案】7:13 硫酸镁、硫酸 7.3 10.5% 
【解析】
根据表格中的数据分析可知, 35g稀硫酸最多消耗镁10g-9.1g=0.9g,则第三次加入35g稀硫酸时,剩余固体质量a=8.2-0.9=7.3,而第四次加入35g稀硫酸时,消耗镁的质量为7.3g-6.5g=0.8g,说明合金中的镁已被消耗完,剩余固体为铜,此时稀硫酸仍有剩余。
(1)根据上述分析得,合金中镁的质量为0.9g+0.9g+0.9g+0.8g=3.5g,铜的质量为10g-3.5g=6.5g,镁与铜的质量比为3.5∶6.5=7∶13;第四次加入稀硫酸反应后,稀硫酸仍有剩余,故反应后的溶液中溶质成分是硫酸和硫酸镁。
(2)由上述分析可得a=7.3;
解:设所加稀硫酸的溶质质量分数为x。
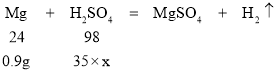
![]()
x=10.5%
答:所加稀硫酸的溶质质量分数为10.5%。
(3)设0.9g镁反应生成氢气质量为y,0.8g镁反应生成氢气质量为z。

![]()
y=0.075g

![]()
z≈0.07g
所以最终产生氢气的质量为0.075g![]() 3+0.07g=0.295g,然后利用描点法绘制图像。
3+0.07g=0.295g,然后利用描点法绘制图像。