题目内容
【题目】已知A-F是初中化学常见物质,它们之间的关系如图所示(“→”表示物质间的转化关系,“—”表示两端的物质能发生化学反应)。C、E为单质,B、D的组成元素相同,E是红色固体,F是目前年产量最高的金属,请回答下列问题

(1)写出化学式:C___________,E___________。
(2)D物质的一种用途是_____________,化学变化都伴随着能量的变化,反应③是________(填“放热”或“吸热”)反应。
(3)写出反应②和④的化学方程式:②_____________,④_________________。
【答案】O2 Cu 作燃料(或冶炼金属) 吸热 ![]()
![]()
【解析】
E为单质且是红色固体,则E为铜;F是目前年产量最高的金属,则F为铁;C为单质,可以和Fe、Cu反应,则C为氧气;B、D的组成元素相同且可以相互转化,D可与其他物质反应生成铜,可知D为一氧化碳,B为二氧化碳;A与氧气之间可以相互转化,且能与二氧化碳发生反应,可知A为水,据此回答问题。
(1)由上述分析可知,C为O2,E为Cu。
(2)由上述分析可知,D为一氧化碳,一氧化碳具有可燃性,可用作燃料,还具有还原性,也可用于冶炼金属;反应③为![]() ,其反应为吸热反应。
,其反应为吸热反应。
(3)反应②的化学方程式为![]() ,反应④的化学方程式为
,反应④的化学方程式为![]() 。
。

【题目】某化学兴趣小组整理实验室时,发现一瓶放置很久的过氧化钠(Na2O2),过氧化钠会在空气中发生变质,于是小组同学一起对该瓶过氧化钠固体的成分进行了探究。
[提出问题]该瓶过氧化钠固体中含有哪些成分?
[查阅资料]①过氧化钠能与水反应生成氢氧化钠和氧气;②过氧化钠会吸收空气中的二氧化碳,生成碳酸钠和氧气。
[初步实验]先取少量过氧化钠固体于试管中,向其中加入足量水,振荡,发现没有气泡产生,说明该固体中一定没有_____________________。
[猜想与假设]
猜想1:Na2CO3
猜想2:NaOH
猜想3:Na2CO3、NaOH
[实验探究]
步骤 | 实验操作 | 实验现象 | 实验结论 |
步骤一 | 取固体样品于试管中,加足量水溶解后,再加入足量的稀盐酸 | ________________。 | 猜想2不成立 |
步骤二 | 取固体样品于试管中,加足量水溶解后,再加入过量的氯化钙溶液,过滤,向滤液中滴加酚酞溶液 | _____________________,溶液变红 | 猜想_____________________成立 |
[反思与评价]步骤二中加入过量氯化钙溶液的目的是_____________________。
[拓展延伸]过氧化钠可用在潜水艇或宇宙飞船等缺氧的场合,原因是_____________________(用化学方程式表示)。
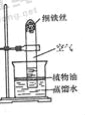
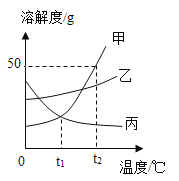
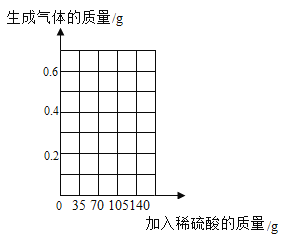
【题目】铜镁合金常用作飞机天线等导电材料。欲测定某铜镁合金的组成(其他元素忽略不计),进行如下实验:取该铜镁合金10g放入烧杯,将140g稀硫酸分4次加入烧杯中,充分反应后,测得剩余固体的质量记录如下。请回答下列问题:
次数 | 1 | 2 | 3 | 4 |
加人稀硫酸质量/g | 35 | 35 | 35 | 35 |
剩余固体质量/g | 9.1 | 8.2 | a | 6.5 |
(1)该铜镁合金中镁与铜的质量比为____________;第4次加入稀硫酸反应后,溶液中溶质成分是____________。
(2)表中a的数值为____________,计算所加稀硫酸的溶质质量分数为_________。
(3)在图中画出加入稀硫酸的质量与生成气体的质量关系的曲线图________。
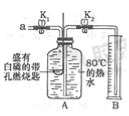
【题目】某同学要探究燃烧的条件和空气中氧气的含量,进行了如下实验.
【实验一】(已知:白磷的着火点为40℃)
实验装置 | 实验步骤及现象 |
| 步骤Ⅰ.检验装置的气密性,气密性良好. 步骤Ⅱ.将盛有白磷的带孔燃烧匙伸入A瓶中,白磷不燃烧. 步骤Ⅲ.向A瓶中加满80℃热水,塞紧瓶塞,白磷不燃烧. 步骤Ⅳ.打开K1、K2,从a口向瓶中鼓入空气,待瓶中的液面低于燃烧匙底部时,关闭K1、K2.此时进入量筒B中水的体积为200mL,观察到A瓶中的白磷燃烧. |
(1)对比步骤Ⅱ和Ⅳ的现象可知,可燃物燃烧的条件之一是
(2)待装置冷却一段时间后,打开K2,如果观察到 ,说明空气中氧气的体积约占![]() .若实验测得空气中氧气的体积分数小于
.若实验测得空气中氧气的体积分数小于![]() ,原因可能是 (答一条即可).
,原因可能是 (答一条即可).
【实验二】用如图所示装置,利用铁生锈的原理也可以比较准确地测出空气中氧气的含量.若将此装置中的细铁丝换成足量的细铜丝进行实验,能否比较准确地测出空气中氧气的含量,并说明理由 .【已知:铜能与空气中氧气、水、二氧化碳反应生成铜绿.化学方程式:2Cu+O2+H2O+CO2═Cu(OH)2CO3】