题目内容
【题目】下列应用和相应的原理(用化学方程式表示)及基本反应类型都正确的是( )
A. 用氢氧化钠溶液吸收二氧化硫:2NaOH+SO2==Na2SO3 + H2O 复分解反应
B. 美丽的溶洞中的钟乳石的形成:CaCO3+CO2+H2O=Ca(HCO3)2 化合反应
C. 拉瓦锡探究质量守恒定律:2HgO=2Hg + O2↑ 分解反应
D. 焦炭还原氧化铁得到铁:2Fe2O3+3C![]() 4Fe +3CO2↑ 置换反应
4Fe +3CO2↑ 置换反应
【答案】D
【解析】
A、用氢氧化钠溶液吸收二氧化硫:2NaOH+SO2==Na2SO3+H2O,应用和相应的原理正确;但该反应不符合复分解反应的特征,不属于复分解反应;故不符合题意;
B、美丽的溶洞中的钟乳石的形成主要是由于可溶性的钙盐变成不溶性的钙盐;其原理为:Ca(HCO3)2=CaCO3![]() +CO2
+CO2![]() +H2O;属于分解反应;应用和相应的原理、基本反应类型均错误;故不符合题意;
+H2O;属于分解反应;应用和相应的原理、基本反应类型均错误;故不符合题意;
C、该化学反应方程式缺少条件,正确的化学方程式应为:2HgO![]() 2Hg+O2↑,为分解反应,方程式错误,故不符合题意;
2Hg+O2↑,为分解反应,方程式错误,故不符合题意;
D、焦炭还原氧化铁得到铁:2Fe2O3+3C![]() 4Fe +3CO2↑;应用和相应的原理正确;该反应符合置换反应的特征,属于置换反应;故符合题意;
4Fe +3CO2↑;应用和相应的原理正确;该反应符合置换反应的特征,属于置换反应;故符合题意;
故选D

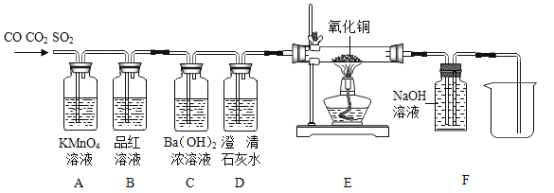
【题目】(探究一)用铁屑按下列流程图制备硫酸亚铁晶体。

(1)反应器所在的厂房要加强通风的原因可能是 ______ 。
(2)滤液M中肯定含有的溶质的化学式是 ______ 、 ______ 。
(3)若在实验室中操作A的名称是 ______ ,完成该操作需要的玻璃仪器有玻璃棒、烧杯和 ______ 。操作A得到的固体残渣的主要成分是 ______ 。
(4)滤液M经过操作B可得硫酸亚铁晶体(FeSO4·7H2O)。已知硫酸亚铁的溶解度和析出晶体的组成如下表:
温度/℃ | 0 | 10 | 20 | 30 | 40 | 50 | 60 | 64 | 70 | 80 | 90 |
溶解度/g | 15.6 | 20.5 | 33.0 | 40.4 | 48.8 | 55.0 | 55.3 | 50.6 | 43.7 | 37.2 | 15.6 |
析出晶体 | FeSO4·7H2O | FeSO4·4H2O | FeSO4·H2O | ||||||||
根据溶解度表,获得硫酸亚铁晶体(FeSO4·7H2O)时,冷却结晶温度最高不超过 ______ ℃。
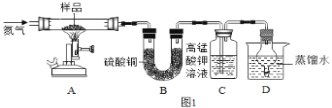
(探究二)某硫酸亚铁晶体(FeSO47H2O)热分解研究:该兴趣小组同学称取ag硫酸亚铁晶体样品按图1高温加热,使其完全分解,对所得产物进行探究。
(5)装置B中硫酸铜粉末变蓝,说明产物中有 ______ ,装置C中高锰酸钾溶液褪色,说明产物中还有 ______ 。
(6)硫酸亚铁晶体完全分解后装置A中固体呈红棕色,放入足量稀盐酸,固体全部溶解,得到黄色溶液,则装置A中红棕色固体是 ______ 。
(7)小明从理论上分析得出硫酸亚铁分解还生成另一物质SO3气体,他打算向装置D中滴入紫色石蕊试液检验生成了SO3,小红认为此法不能达到实验目的,小红作出这样判断的理由是 ______ 。
(8)装置D球形干燥管的作用 ______ 。
(9)根据以上实验事实,写出硫酸亚铁晶体受热分解的化学方程式 ______ 。