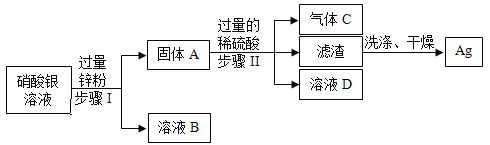
题目内容
【题目】某兴趣小组为了探究一瓶久置的氢氧化钠溶液的变质情况,取出100g该溶液样品进行实验,依次加入质量分数4.9%的稀硫酸,测得的实验数据如下表所示:
实验编号 | ① | ② | ③ | ④ | ⑤ |
稀硫酸的质量(g) | 20.0 | 40.0 | 60.0 | 80.0 | 100.0 |
溶液的总质量(g) | 120.0 | 140.0 | 159.78 | 179.56 | 199.56 |
请回答下列问题:
(1)实验①﹑②没有产生气体的原因是 。
(2)100g溶液样品中碳酸钠的质量 。
(3)计算100g溶液样品中已经变质的氢氧化钠的质量(写出计算过程)
(3)分析实验数据,在图中,画出加入4.9%的稀硫酸质量0—80.0g过程中,产生气体质量对应的变化图,并标注必要的数值。
【答案】(1)氢氧化钠先与稀硫酸反应 (2)1.06g (3) 0.8g (4)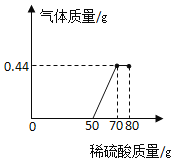
【解析】
(1)氢氧化钠发生变质,则溶质为氢氧化钠和碳酸钠,加入酸后,酸先与碱反应,所以不会产生气体;
(2)生成气体致使溶液质量减少,所以生成二氧化碳质量=200g-199.56g=0.44g,碳酸钠中碳元素质量=二氧化碳中碳元素质量,所以设碳酸钠质量为m,m×![]() ×100%=0.44g×
×100%=0.44g×![]() ×100%,m=1.06g;
×100%,m=1.06g;
(3)设100g样品中已经变质的氢氧化钠的质量为x,
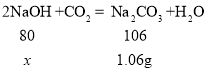
![]()
x = 0.8g;
(4) 根据上述实验可知二氧化碳质量最大为0.44g,在加入60g硫酸时,有气体生成,说明此时有碳酸钠参与反应,此时消耗硫酸质量为n,
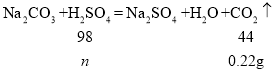
![]()
n=0.49g,消耗硫酸溶液质量=0.49g÷4.9%=10g,所以氢氧化钠消耗了50g稀硫酸质量,而当二氧化碳全部生成时,消耗硫酸质量为y,此时二氧化碳质量为0.44g,![]() ,y=0.98g,消耗硫酸溶液质量=0.98g÷4.9%=20g,所以在加入70g硫酸时全部反应完毕,因此在50g硫酸质量时开始生成气体,70g硫酸质量生成二氧化碳质量最大为0.44g,70g-80g加入硫酸后质量不再增加,如图:
,y=0.98g,消耗硫酸溶液质量=0.98g÷4.9%=20g,所以在加入70g硫酸时全部反应完毕,因此在50g硫酸质量时开始生成气体,70g硫酸质量生成二氧化碳质量最大为0.44g,70g-80g加入硫酸后质量不再增加,如图: 。
。

【题目】某兴趣小组发现铁钉生锈需要几天的时间,询问老师如何加快铁钉生锈的速度。老师说氯化物可能加快铁钉生锈的速度。大家将铁钉放入加有氯化铜溶液的蒸馏水中(如图所示)。观察到7分钟时铁钉表面出现红色,20分钟后试管底部出现红色沉淀。
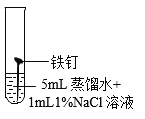
(提出问题)红色沉淀物是什么?
(做出猜想)小明认为可能是铁锈(写出铁锈主要成分的化学式:___________。
小陈认为可能是铜。
小陈认为红色沉淀物是铜的理由是______________(用文字描述)。
(设计实验)
实验操作 | 实验现象 |
取红色沉淀物于试管中,加入足量的稀盐酸 | 红色沉淀物大部分溶解,溶液变成黄色 |
(1)根据实验现象,红色沉淀物中一定含有铁锈,原因是______________(用化学方程式表示);经过讨论,同学们一致认为红色沉淀物是铁锈和铜的混合物。
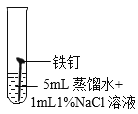
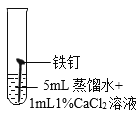
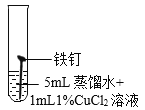
(继续探究)影响铁锈蚀的因素有哪些?
试管 编号 | ① | ② | ③ | ④ |
实验 |
|
|
|
|
现象 | 2天后,铁钉表面出现红色 | 1天后,铁钉表面出现红色 | 1天后,铁钉表面出现红色 | 7分钟时铁钉表面出现红色,20分钟后试管底部出现红色沉淀 |
(2)实验①的作用是_______________。
(3)根据上述实验可以得到的结论是___________。
(4)根据上述实验,沿海地区铁制品易锈蚀除因空气潮湿外,还可能的原因是_____________。
(5)影响铁制品锈蚀快慢除上述因素外,还有_____________(写一 点即可),请设计实验方案进行验证_________。
【题目】某实验小组的同学为了测定CaCl2和NaCl的混合物中CaCl2的含量,他们取样品25.8g于烧杯中,加入134.2g水全部溶解,再多次加入某Na2CO3溶液充分反应。加入Na2CO3溶液 与产生沉淀的质量如下表所示:
Na2CO3溶液/g | 10 | 10 | 10 | 10 | 10 | 10 |
沉淀质量/g | 5 | 10 | 15 | 20 | 20 | m |
(1)Na2CO3中钠、碳、氧三种元素的质量比为_____,表中m=_____。
(2)样品中CaCl2的质量是____;恰好完全反应时,所得溶液中溶质的质量分数是____。