题目内容
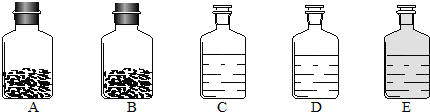
工业上的常说“三酸两碱”是重要的化工原料.实验室桌面上的五个试剂瓶内(如下图)分别装有属于工业上“三酸两碱”中的“三种浓酸”和“两碱固体”.
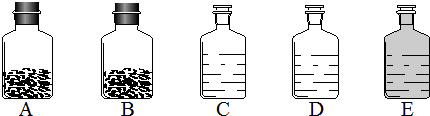
(1)小袁同学没有利用任何试剂就鉴定出了C、D、E三瓶中的三种浓酸.他的做法是:①直接观察试剂瓶颜色,棕色试剂瓶E内的是
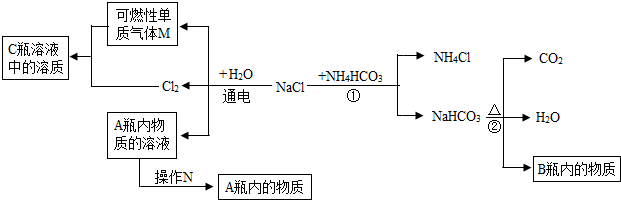
(2)小白同学在查阅A、B瓶内的“两碱”的制备方法时,根据收集的信息,绘制了如下一个框图.
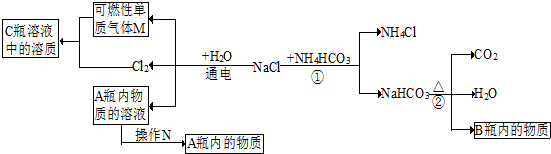
注:整个框图中每个化学反应涉及的物质已全部给出.根据框图,依据化学反应前后元素种类守恒的相关知识,回答下列问题.
Ⅰ.写出A、B瓶内物质的化学式:
Ⅱ.框图中的①反应的化学方程式
Ⅲ.请选用一种方法鉴别A、B瓶内的物质:
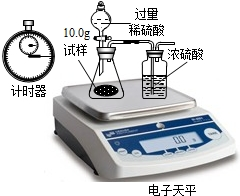
(3)小顾同学想利用D瓶内溶质质量分数为98%的浓硫酸来配制10%的稀硫酸196g,计算说明他应取浓硫酸多少毫升?水多少毫升?(水密度1g/cm3、浓硫酸密度1.84g/cm3)(写出计算过程)

(1)小袁同学没有利用任何试剂就鉴定出了C、D、E三瓶中的三种浓酸.他的做法是:①直接观察试剂瓶颜色,棕色试剂瓶E内的是
浓硝酸
浓硝酸
(填名称);②分别打开C、D瓶的瓶塞,观察到C瓶的瓶口冒白雾
C瓶的瓶口冒白雾
,说明C瓶内的是浓盐酸,D瓶内的是浓硫酸.(2)小白同学在查阅A、B瓶内的“两碱”的制备方法时,根据收集的信息,绘制了如下一个框图.

注:整个框图中每个化学反应涉及的物质已全部给出.根据框图,依据化学反应前后元素种类守恒的相关知识,回答下列问题.
Ⅰ.写出A、B瓶内物质的化学式:
NaOH
NaOH
、Na2CO3
Na2CO3
.Ⅱ.框图中的①反应的化学方程式
NaCl+NH4HCO3═NaHCO3↓+NH4Cl
NaCl+NH4HCO3═NaHCO3↓+NH4Cl
,反应的基本类型是复分解反应
复分解反应
,框图中的②反应的化学方程式2NaHCO3
Na2CO3+H2O+CO2↑
| ||
2NaHCO3
Na2CO3+H2O+CO2↑
,反应的基本类型是
| ||
分解反应
分解反应
,操作N的名称是蒸发
蒸发
.Ⅲ.请选用一种方法鉴别A、B瓶内的物质:
分别从两瓶内取少量固体溶于水,明显放热的为NaOH,否则为Na2CO3
分别从两瓶内取少量固体溶于水,明显放热的为NaOH,否则为Na2CO3
.(要求说出方法,现象和对应的结论.)(3)小顾同学想利用D瓶内溶质质量分数为98%的浓硫酸来配制10%的稀硫酸196g,计算说明他应取浓硫酸多少毫升?水多少毫升?(水密度1g/cm3、浓硫酸密度1.84g/cm3)(写出计算过程)
分析:(1)根据浓硝酸和浓盐酸易挥发进行分析;
(2)Ⅰ、氯化钠和水通电后生成了氯气,和可燃性的气体单质M,根据质量守恒定律可知,M是氢气,A是氢氧化钠;碳酸氢钠受热后生成了水、二氧化碳和B,根据质量守恒定律可知,B是碳酸钠;
II、根据反应①是氯化钠和碳酸氢铵反应生成碳酸氢钠和氯化铵以及框图中的②反应是碳酸氢钠在受热后分解成碳酸钠、水和二氧化碳进行分析;根据操作N可以将固体从液体分离来分析;
III、根据氢氧化钠溶于水有明显的温度变化进行分析;
(3)根据稀释前后溶液中的溶质质量不变进行分析.
(2)Ⅰ、氯化钠和水通电后生成了氯气,和可燃性的气体单质M,根据质量守恒定律可知,M是氢气,A是氢氧化钠;碳酸氢钠受热后生成了水、二氧化碳和B,根据质量守恒定律可知,B是碳酸钠;
II、根据反应①是氯化钠和碳酸氢铵反应生成碳酸氢钠和氯化铵以及框图中的②反应是碳酸氢钠在受热后分解成碳酸钠、水和二氧化碳进行分析;根据操作N可以将固体从液体分离来分析;
III、根据氢氧化钠溶于水有明显的温度变化进行分析;
(3)根据稀释前后溶液中的溶质质量不变进行分析.
解答:解:(1)浓硝酸有强烈的挥发性,浓硝酸因溶解由分解产生的NO2而呈黄色,常将浓硝酸盛放在棕色试剂瓶中,浓盐酸会发出的氯化氢气体和空气中的水蒸气结合形成的盐酸小液滴,在瓶口形成白雾;故答案为:浓硝酸;C瓶的瓶口冒白雾;
(2)Ⅰ、氯化钠和水通电后生成了氯气,和可燃性的气体单质M,根据质量守恒定律可知,M是氢气,A是氢氧化钠;碳酸氢钠受热后生成了水、二氧化碳和B,根据质量守恒定律可知,B是碳酸钠;故答案为:NaOH;Na2CO3,
Ⅱ.反应①是氯化钠和碳酸氢铵反应生成碳酸氢钠和氯化铵,反应的化学方程式NaCl+NH4HCO3═NaHCO3↓+NH4Cl,①反应是两种化合物反应生成了两种化合物的反应,满足复分解反应的条件;框图中的②反应是碳酸氢钠在受热后分解成碳酸钠、水和二氧化碳,反应的化学方程式2NaHCO3
Na2CO3+H2O+CO2↑,一种物质反应生成三种物质,属于分解反应;蒸发是使固体从液体之后析出的一种操作方法,A瓶内物质的溶液经过操作N分离出了固体;故答案为:NaCl+NH4HCO3═NaHCO3↓+NH4Cl;复分解反应; 2NaHCO3
Na2CO3+H2O+CO2↑;分解反应;蒸发;
Ⅲ.氢氧化钠在水中溶解时会放出大量的热,故答案为:分别从两瓶内取少量固体溶于水,明显放热的为NaOH,否则为Na2CO3;
(3)设应取浓硫酸的质量为x,
x×98%=196g×10%
x=20g
浓硫酸的体积=
=10.87mL
水的体积=
=176mL
答:应取浓硫酸10.87mL,水176mL.
(2)Ⅰ、氯化钠和水通电后生成了氯气,和可燃性的气体单质M,根据质量守恒定律可知,M是氢气,A是氢氧化钠;碳酸氢钠受热后生成了水、二氧化碳和B,根据质量守恒定律可知,B是碳酸钠;故答案为:NaOH;Na2CO3,
Ⅱ.反应①是氯化钠和碳酸氢铵反应生成碳酸氢钠和氯化铵,反应的化学方程式NaCl+NH4HCO3═NaHCO3↓+NH4Cl,①反应是两种化合物反应生成了两种化合物的反应,满足复分解反应的条件;框图中的②反应是碳酸氢钠在受热后分解成碳酸钠、水和二氧化碳,反应的化学方程式2NaHCO3
| ||
| ||
Ⅲ.氢氧化钠在水中溶解时会放出大量的热,故答案为:分别从两瓶内取少量固体溶于水,明显放热的为NaOH,否则为Na2CO3;
(3)设应取浓硫酸的质量为x,
x×98%=196g×10%
x=20g
浓硫酸的体积=
| 20g |
| 1.84g/ml |
水的体积=
| 196g-20g |
| 1g/ml |
答:应取浓硫酸10.87mL,水176mL.
点评:在做此类题时,首先要知道需要鉴别的物质的有哪些特性,然后根据这些性质设计实验进行验证.

练习册系列答案
相关题目