题目内容
【题目】某铜矿样品的主要成分是碱式碳酸铜,化学式为Cu2(OH)2CO3。现称取29.6t纯度为75%的该样品放入烧杯中,加入一定量的稀盐酸,恰好完全反应后,所得氯化铜溶液的溶质质量分数为27 %。
提示: 1.![]() ;
;
2.铜矿中杂质既不溶于水,也不参与反应;
3.Cu2(OH)2CO3的相对分子质量为222。
求: (1) Cu2(OH)2CO3中质量分数最大的元素是______________。
(2)上述稀盐酸的溶质质量分数是多少?____ 。(写出计算过程,最终结果精确到0.1%)
(3)工业上结合该方法,继续反应可提炼出铜单质。假设提纯时铜元素无损失,每得到1t铜单质的成本为M元,提纯上述样品的成本是______________元。
【答案】Cu 17.8% 12.8M
【解析】
(1) 根据化学式Cu2(OH)2CO3,Cu、O、H、C四种元素的质量比为:(64×2)∶(16×5)∶(1×2)∶12=128∶80∶2∶12,因此Cu2(OH)2CO3中质量分数最大的元素是:Cu。
(2)根据题意,样品中碱式碳酸铜的质量=29.6t×75%=22.2 t。
设参加反应的盐酸中溶质HCl的质量为x,生成的CuCl2质量为y,生成的二氧化碳质量为z。
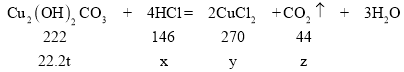
![]() 解得x=14.6t
解得x=14.6t
![]() 解得y=27.0t
解得y=27.0t
![]() 解得z=4.4t
解得z=4.4t
根据反应后溶液中氯化铜溶液的溶质质量分数为27 %,反应后溶液=![]()
结合题中提示:铜矿中杂质既不溶于水,也不参与反应,设参加反应的盐酸溶液质量为m,根据质量守恒定律, 22.2t+m-4.4t=100t,解得m=82.2t。
参加反应的稀盐酸的溶质质量分数是:![]()
(3)根据题意,假设提纯时铜元素无损失,则提炼出铜单质的质量可以由反应生成的氯化铜的质量求得(或根据碱式碳酸铜的质量求得)。
可提炼出铜单质的质量为:![]()
根据每得到1t铜单质的成本为M元,则提纯上述样品的成本是:12.8t×M元/t=12.8M元。
答:(1) Cu2(OH)2CO3中质量分数最大的元素是铜(或Cu)。
(2)稀盐酸的溶质质量分数是17.8%。
(3)提纯上述样品的成本是12.8M元。

 备战中考寒假系列答案
备战中考寒假系列答案