题目内容
【题目】实验室有一瓶保存不当而发生变质的氢氧化钠,小松想利用该样品配制纯净的氢氧化钠溶液,设计流程如下:
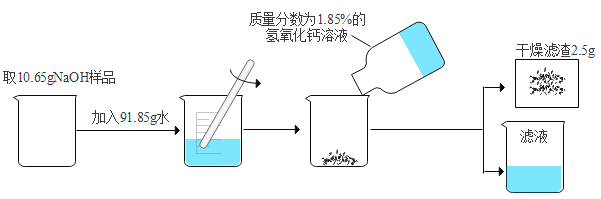
(1)实验中发生反应的化学方程式为_____;
(2)根据已知条件,求解样品中发生反应的物质的质量(x)的比例式为_____;
(3)所加氢氧化钙溶液的质量为_____;
(4)样品中已变质的氢氧化钠占原变质前氢氧化钠的质量分数为_____;
(5)最终所得到的滤液中溶质的质量分数为_____;
(6)若用实验制得的纯净的氢氧化钠溶液恰好中和掉了实验室中只含有硫酸的废液 122.5g,则该硫酸废液溶质的质量分数为_____。
【答案】Na2CO3+Ca(OH)2═CaCO3↓+2NaOH ![]() 100g 20% 5% 10%
100g 20% 5% 10%
【解析】
(1)氢氧化钠在空气中变质为碳酸钠,实验中碳酸钠和氢氧化钙反应生成碳酸钙沉淀和氢氧化钠,发生反应的化学方程式为:Na2CO3+Ca(OH)2═CaCO3↓+2NaOH;故填:Na2CO3+Ca(OH)2═CaCO3↓+2NaOH;
(2)由实验流程可知,生成碳酸钙的质量为2.5g
设样品中发生反应的物质的质量为x,

x=2.65g
故填:![]() ;
;
(3)参加反应的氢氧化钙的质量为y,
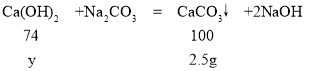
![]()
解得y=1.85g
所加氢氧化钙溶液的质量为:![]() =100g
=100g
答:所加氢氧化钙溶液的质量为100g;
(4)设样品中已变质的氢氧化钠质量为m

m=2g
样品中已变质的氢氧化钠占原变质前氢氧化钠的质量分数为:![]() ;
;
故填:20%;
(5)设生成氢氧化钠的质量为z
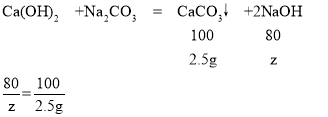
z=2g
最终所得到的滤液中溶质的质量分数为:![]() =5%;
=5%;
答:最终所得到的滤液中溶质的质量分数为5%。
(6)设该硫酸废液溶质的质量分数为a,
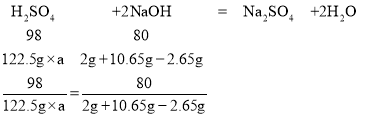
a=10%
答:该硫酸废液溶质的质量分数为10%;
故填:10%。

练习册系列答案
相关题目