题目内容
【题目】如图是甲、乙两物质的溶解度曲线,下列说法正确的是
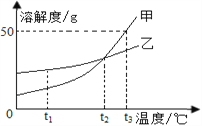
A. t3 ℃时,甲的溶解度为50
B. t2 ℃时,甲、乙饱和溶液中溶质的质量分数相等
C. 将甲溶液从t3 ℃降温至t1 ℃,一定有晶体析出
D. 若甲中含有少量乙,可用溶解、过滤的方法提纯甲
【答案】B
【解析】根据所学知识和题中信息知,A、t3 ℃时,甲的溶解度为50g,溶解度单位是克,故A错误;B、t2 ℃时,甲、乙两物质溶解度相等,它们的饱和溶液中溶质的质量分数相等,溶质的质量分数为![]() ×100%,故B正确;C、甲物质溶解度随温度的升高而增大,将甲饱和溶液从t3 ℃降温至t1 ℃,一定有晶体析出,若溶液不饱和,无法确定,故C错误;D、甲物质溶解度随温度的升高而增大,乙物质溶解度随温度的升高而变化不大,若甲中含有少量乙,可用溶解、冷却结晶的方法提纯甲,故D错误。
×100%,故B正确;C、甲物质溶解度随温度的升高而增大,将甲饱和溶液从t3 ℃降温至t1 ℃,一定有晶体析出,若溶液不饱和,无法确定,故C错误;D、甲物质溶解度随温度的升高而增大,乙物质溶解度随温度的升高而变化不大,若甲中含有少量乙,可用溶解、冷却结晶的方法提纯甲,故D错误。
点睛∶溶解度曲线的意义①表示同一种物质在不同温度时的溶解度或溶解度随温度变化的情况;②表示不同物质在同一温度时的溶解度,可以比较同一温度时,不同物质的溶解度的大小。若两种物质的溶解度曲线相交,则在该温度下两种物质的溶解度相等;③根据溶解度曲线可以确定从饱和溶液中析出晶体或进行混合物分离提纯的方法;④根据溶解度曲线能进行有关的计算。

【题目】将一小块银白色的金属钠放置在空气中会发生下列变化:
![]()
[查阅资料]
I.钠的氧化物有氧化钠(Na2O)和过氧化钠(Na2O2),都能与水反应,反应化学方程式如下:Na2O + H2O = 2NaOH 2Na2O2 + 2H2O = 4NaOH + O2↑
II. CaCl2溶液呈中性;碳酸钠溶液能与CaCl2溶液或Ca(OH)2溶液发生复分解反应;
碳酸钠溶液与盐酸反应方程式有:Na2CO3 +HCl=NaHCO3 +NaCl、Na2CO3+2HCl=2NaCl+H2O+CO2↑
(1)为检验常温下钠与氧气反应的产物,是Na2O还是Na2O2,完成实验方案:
选取试剂 | 实验现象 | 实验结论 |
__________________ | __________________________ | 产物为Na2O |
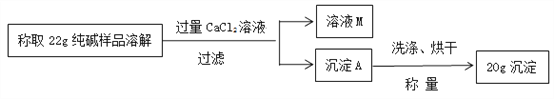
⑵ 钠在空气中放置一段时间得到白色固体的成分
猜想1:Na2CO3 猜想2:NaOH 猜想3:Na2CO3和NaOH
[实验过程]
[实验1] 取少量白色固体加水配成溶液,再滴入几滴稀盐酸,无气泡产生。
化学小组认为:据此现象,还不能得出猜想2成立。理由是________________。
[实验2] 化学小组进行如下实验
实验操作 | 实验现象 | 实验结论 |
①取少量白色固体配成溶液,加入足量_______; | _______ | 猜想3成立 |
②过滤,取少量滤液滴入________________。 | _________ |