��Ŀ����
����Ŀ������λͬѧ�ֱ�̽��Al��Fe��Cu���ֽ����Ļ��ǿ����

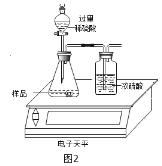
��1��С���ʵ����Ʒ�������ͼ��ʾ��B�Թ��з�����Ӧ�Ļ�ѧ����ʽΪ____________________�� A�Թ���С���ںܳ�ʱ���ڶ�δ�۲쵽Ԥ�ڵ�ʵ��������ԭ�������___________________��
��˼�Ľ�ʵ��ɹ���С�����֧�Թ�����������һ�������ձ��У���ַ�Ӧ���ձ������в����Թ��壬Ϊ��С�����չ��̽����
[�������]�����Թ����к�����Щ�ɷ֣�
[ʵ�鲢�ó�����]���ˣ����˳��IJ����Թ���μ�������ϡ���ᣬ������ð������ò����Թ�����һ�����е�������________��һ��������Ӧ�Ļ�ѧ����ʽ��______________________��
��2��С���ñ������ȵ��������ֽ���Ƭ�ֱ����Ũ�ȵ������ϡ���ᷴӦҲ�����ͬ����̽��Ŀ�ģ�ȴ���ⷢ����Ƭ�м�ϡ�������Һ��Ϊ��ɫ���Է�����ԭ��________________(�û�ѧ����ʽ�ش�)��
С��ʵ�������Һ���У����������������������账����pH=7�����ŷš�������Һʱ����pH��ֽ��ɹ�ѡ������������в��ʺϵ���_____________��(�����)
a ʯ����Һ b ��ʯ�� c AgNO3��Һ d NaHCO3��Һ e NaOH��Һ
���𰸡�Fe + CuSO4 = Cu + FeSO4 ��˿����������������Ĥ Fe��Cu Fe + H2SO4 = FeSO4 + H2�� Fe2O3 + 6HCl = 2FeCl3 + H2O a��c
��������
��1����������ͭ��Ӧ��������������ͭ����Ӧ�ķ���ʽΪ��Fe + CuSO4 = Cu + FeSO4��A�Թ���С���ںܳ�ʱ���ڶ�δ�۲쵽Ԥ�ڵ�ʵ��������ԭ�������������������������Ĥ��
[ʵ�鲢�ó�����] ��Ϊ���������ã������ᷴӦ�����˳��IJ����Թ���μ�������ϡ���ᣬ������ð��˵��������һ�������������к�������������ͭ����ȫ��Ӧ����һ����ͭ���ɣ��ʣ������к�������ͭ������ϡ���ᷴӦ��������������ͭ����Ӧ�ķ���ʽΪ��Fe + H2SO4 = FeSO4 + H2����
��2����Ƭ��������������������������ϡ���ᷴӦ������������ˮ����Һ��Ϊ��ɫ����Ӧ�ķ���ʽΪ��Fe2O3 + 6HCl = 2FeCl3 + H2O��
��3��b ��ʯ�� �� d NaHCO3��Һ �� e NaOH��Һ��������ϡ���ᷢ����Ӧ��ʹ��Һ��Ϊ���ԣ���ʯ����Һ��c AgNO3��Һ ����ʹ��Һ��Ϊ���ԣ���ѡac.

 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�