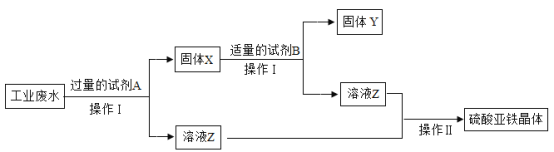
题目内容
【题目】小刚、小军、小红对一份久置的NaOH白色粉末的成分进行探究并测定其成分的含量。
(一)成分的确定:小红设计了如图1所示实验方案:
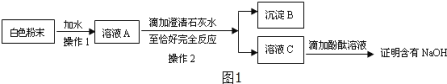
(1)在操作1中要用到玻璃棒,其作用是_____;在操作2中得到沉淀B,写出生成沉淀B的化学方程式_____。
(2)小刚认为小红的这个方案有问题,不能证明含有NaOH,但只要稍加改进,就可以证明粉末中还含有NaOH,则小刚改进的方法是_______。小刚对小红的实验作了正确的改进后进行了实验,实验现象和小红的一致,由此确定固体中含有NaOH。
(二)各成分含量的测定:
小军同学利用电子天平做了如图2所示测定生成CO2的质量实验。
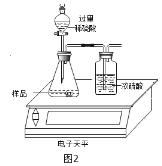
(1)写出锥形瓶中发生反应化学方程式:_____。
(2)有同学提出按上述实验所测得试样中Na2CO3质量分数会偏小,该同学的理由是______(实验操作均正确).
(3)根据反应的化学方程式分析,NaOH部分变质或全部变质,与没有变质前的NaOH相比,恰好完全反应时消耗硫酸的量_____(填“相等”、“大于”或“小于”)。
【答案】加快溶质的溶解速率 Ca(OH)2+Na2CO3=CaCO3↓+2NaOH 将滴加澄清石灰水改为过量的CaCl2溶液(或BaCl2溶液) 2NaOH+H2SO4═Na2SO4+2H2O 、Na2CO3+H2SO4═Na2SO4+H2O+CO2↑ 会有CO2残留在装置中 相等
【解析】
(一)(1)溶解时用玻璃棒搅拌,可以加快溶质的溶解速率,故填加快溶质的溶解速率;
操作2中得到的沉淀B是碳酸钙,生成碳酸钙的反应是氢氧化钠变质后生成的碳酸钠与石灰水中的氢氧化钙反应生成碳酸钙沉淀和氢氧化钠,故反应的化学方程式写为:Ca(OH)2+Na2CO3=CaCO3↓+2NaOH。
(2)碳酸钠与氢氧化钙反应后生成氢氧化钠,生成的氢氧化钠会对检验白色粉末中是否含有氢氧化钠产生干扰,应将滴加澄清石灰水改为过量的CaCl2溶液(或BaCl2溶液),避免生成氢氧化钠,故填将滴加澄清石灰水改为过量的CaCl2溶液(或BaCl2溶液)。
(二)(1)锥形瓶中发生的反应有:稀硫酸与氢氧化钠反应生成硫酸钠和水,稀硫酸与碳酸钠反应生成蓝、水和二氧化碳,故反应的化学方程式写为:2NaOH+H2SO4═Na2SO4+2H2O、Na2CO3+H2SO4═Na2SO4+H2O+CO2↑。
(2)反应后,有一部分二氧化碳残留在锥形瓶中,造成计算出的二氧化碳的质量偏小,据此计算出碳酸钠的质量也偏小,故填会有CO2残留在装置中。
(3)由质量守恒定律分析可知,反应前后,无论氢氧化钠是否变质,其中钠元素的质量都是相同的,反应后生成硫酸钠的质量相等,那么反应时消耗硫酸的质量也相同,故填相等。

【题目】写出下列反应的化学方程式,并按要求回答问题:
化学反应 | 有关的化学方程式 | 简答 |
铁丝在氧气中燃烧 | _____ | 反应中铁元素从_____态变成_____态 |
镁带燃烧 | _____ | 反应物物质的量之比为_____ |
硫粉在氧气中燃烧 | _____ | 集气瓶内预先放少量水的目的是_____ |