题目内容
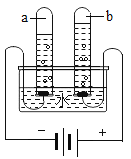
【题目】利用如图1装置,小卫设计并实施了下列实验,(压强传感器用于测量抽滤瓶内压强变化:各数据均于同温下测定获得)
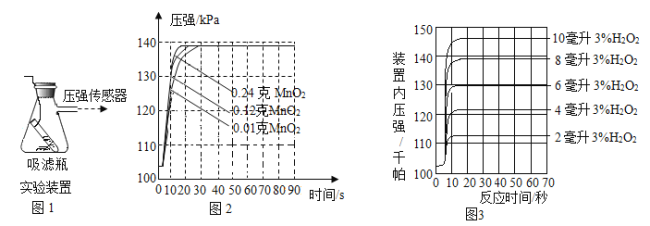
实验Ⅰ:再小试管中加入8mL溶质质量分数为3%的双氧水(ρ=1g/mL),在抽滤瓶中分别加入不同质量的MnO2,使其反应并启动传感器,记录容器内压强变化于图2中.
实验Ⅱ:在抽滤瓶中加入0.1g MnO2,在小试管中分别加入不同体积溶质质量分数为3%的双氧水,使其反应并启动传感器,记录容器内压强变化于图3中.
请根据以上实验回答下列问题:
(1)使容器内压强增大的反应的文字表达式:_____________________;
(2)根据图2可发现,该实验条件下,30s内催化分解8mL溶质质量分数为3%的双氧水,MnO2的最小用量为______________g;
(3)根据图3可发现,0.1g MnO2至少能快速催化分解__________g过氧化氢;
(4)根据图2与图3可发现,MnO2的用量总体上与O2产量_____________(填“正相关”、“不相关”或“负相关”),根据图3还可发现,该试验中,O2产量总体上与双氧水用量是___________(填“正比”或“反比”);
(5)下列因素中,与本实验所测数据的精确度有关的是__________ 。
A 反应容器的气密性 B 称量MnO2质量的精准度 C 量取双氧水体积的精准度
【答案】过氧化氢![]() 水+氧气 0.01g 0.3g 不相关 正比 AC
水+氧气 0.01g 0.3g 不相关 正比 AC
【解析】
(1)过氧化氢分解产生水和氧气:过氧化氢![]() 水+氧气;
水+氧气;
(2)由图2可知:30s内催化分解8mL溶质质量分数为3%的双氧水,MnO2的最小用量为0.01g;
(3)0.1g MnO2至少能快速催化分解10mL过氧化氢溶液,过氧化氢溶液中溶质质量为:10mL×1g/mL×3%=0.3g;
(4)二氧化锰用量与氧气产量无关;过氧化氢溶液越大,产生的氧气越多,成正比;
(5)装置气密性不好生成的氧气容易泄露,测量氧气体积不准确;二氧化锰作催化剂,不影响而产生氧气体积的大小;双氧水的体积直接影响产生氧气体积的多少;

 永乾教育寒假作业快乐假期延边人民出版社系列答案
永乾教育寒假作业快乐假期延边人民出版社系列答案