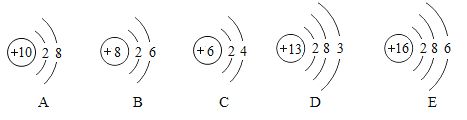题目内容
【题目】现有一包不纯的Na2SO4固体,可能含有Fe(NO3)3、CaCO3、NaCl、MgCl2、Ba(OH)2中的一种或几种,现做如下实验:
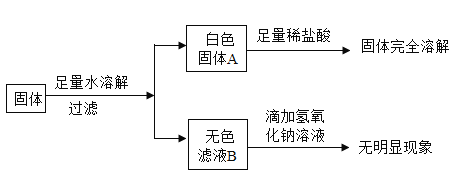
(1)原固体一定不含有__________________;一定含有______________________。
(2)另取少量滤液B,先滴加过量的___________溶液,静置,再滴加AgNO3溶液,出现白色沉淀,则原固体中还含有NaCl。
【答案】Fe(NO3)3、Ba(OH)2、MgCl2 CaCO3 Ba(NO3)2
【解析】
(1)碳酸钙和盐酸反应生成氯化钙而完全溶解,硫酸钡沉淀不溶于酸;样品加水溶解后,生成白色沉淀和无色溶液,白色沉淀和足量盐酸反应后沉淀完全溶解,原固体一定不含Fe(NO3)3、Ba(OH)2,一定含有碳酸钙;溶液中加入氢氧化钠后无明显现象,说明样品中一定没有氯化镁;
(2)硫酸银微溶于水,会影响氯离子的检验,检验氯化钠时,另取少量滤液B,先滴加过量的硝酸钡溶液,将硫酸根离子转化成硫酸钡沉淀,静置,再滴加AgNO3溶液,出现白色沉淀,则原固体中还含有NaCl。

练习册系列答案
 举一反三期末百分冲刺卷系列答案
举一反三期末百分冲刺卷系列答案
相关题目